题目内容
在某温度下,难溶电解质在水中的离子浓度乘积是一个常数(此常数用KSP表示,KSP和水的KW相似).某混合溶液中含有溶质NaCl、KI和Na2S各0.1mol,往该溶液中加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化的关系如图所示.
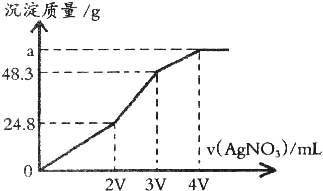
(1)根据图象判断三种沉淀物的浓度积常数大小(由大到小排列) .
(2)由上述KSP判断,在上述体系中,能否实现AgI向AgCl的转化?请判断能否转化 (填“能”或“不能”)若能,请写出实验转化的必要条件;若不能,请简述理由 .

(1)根据图象判断三种沉淀物的浓度积常数大小(由大到小排列)
(2)由上述KSP判断,在上述体系中,能否实现AgI向AgCl的转化?请判断能否转化
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:(1)NaCl、KI和Na2S各0.1mol,生成的AgCl、AgI、Ag2S沉淀质量分别为143.5g、23.5g、24.8g,据图上数据分析沉淀的先后顺序,判断其沉淀的溶度积;
(2)当Q>Ksp时,开始生成沉淀,据此分析.
(2)当Q>Ksp时,开始生成沉淀,据此分析.
解答:
解:(1)开始生成沉淀质量为24.8g说明生成的沉淀是Ag2S,生成沉淀48.3g-24.8g=23.5g.恰好是0.1molAgI的质量,说明在生成的沉淀是AgI,最后生成AgCl沉淀,所以三种沉淀物的溶度积大小顺序为:Ksp(AgCl)>Ksp(AgI)>Ksp(Ag2S),故答案为:Ksp(AgCl)>Ksp(AgI)>Ksp(Ag2S);
(2)在AgI的沉淀溶解平衡体系中,当溶液中氯离子浓度很大,导致Q(AgCl)>Ksp(AgCl)时,可以实现AgI向AgCl的转化,故答案为:能;当溶液中氯离子浓度很大,导致Q(AgCl)>Ksp(AgCl)时,可以实现AgI向AgCl的转化.
(2)在AgI的沉淀溶解平衡体系中,当溶液中氯离子浓度很大,导致Q(AgCl)>Ksp(AgCl)时,可以实现AgI向AgCl的转化,故答案为:能;当溶液中氯离子浓度很大,导致Q(AgCl)>Ksp(AgCl)时,可以实现AgI向AgCl的转化.
点评:本题考查了沉淀的生成和转化,注意利用Q和Ksp的比较进行判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述正确的是( )
| A、苯、乙烯都既能发生加成反应,又能发生氧化反应 |
| B、石油的分馏和煤的干馏都是物理变化 |
| C、淀粉、植物油和蛋白质都是天然高分子,在一定条件下都能发生水解反应 |
| D、棉花、蚕丝、羊毛燃烧后都只生成CO2和H2O |
元素周期表中短周期的一部分如图,关于X、Y、Z、W、Q说法正确的是( )


| A、元素Y与元素Z的最高正化合价之和的数值等于9 |
| B、原子半径的大小顺序为:W>Z>Y |
| C、离子半径的大小顺序为:W2->Y2->Z3+ |
| D、W的气态氢化物的热稳定性和还原性均比Q强 |
下列说法正确的是( )
| A、石油的分馏以及煤的干馏、气化、液化,都涉及到化学变化 |
| B、食用一定量的油脂能促进人体对某些维生素的吸收 |
| C、严重影响我国北方的霾尘,其颗粒物是胶体粒子 |
| D、合成纤维和光导纤维都是新型无机非金属材料 |
下列说法中正确的是( )
| A、摩尔是可以把物质的质量与微观粒子数联系起来的一个基本物理量 |
| B、0.012 kg 12C中所含的碳原子数为NA |
| C、物质的摩尔质量等于其相对分子(原子)质量 |
| D、1mol任何物质都含有约6.02×1023个原子 |
下列离子方程式书写正确的是( )
| A、向NaClO溶液中通入少量CO2的离子方程式:ClO-+CO2+H2O=HClO+HCO3- |
| B、碳酸钙溶于稀醋酸:CO32-+2H+=H2O+CO2↑ |
| C、铜与稀硝酸反应:3Cu+2NO3-+8H +=3Cu2++2NO↑+4H2O |
| D、一小块钠投入到CuSO4溶液中:2Na+Cu2+=Cu+2Na+ |
胶体区别于其它分散系的本质特征是( )
| A、分散质粒子直径在1nm~100nm之间 |
| B、产生丁达尔现象 |
| C、胶体的分散质能通过滤纸空隙,而浊液的分散质不能 |
| D、胶体在一定条件下能稳定存在 |
 某校化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集2瓶干燥.纯净的氯气.为防止换集气瓶时生成的氯气污染空气,设计了如下装置:
某校化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集2瓶干燥.纯净的氯气.为防止换集气瓶时生成的氯气污染空气,设计了如下装置: