题目内容
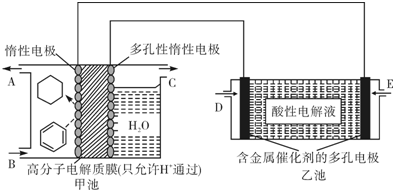
用酸性氢氧燃料电池(乙池)为电源进行电解的实验装置(甲池,一定条件下可实现有机物的电化学储氢)如下图所示.甲池中A为含苯的物质的量分数为10%的混合气体,B为10mol混合气体其中苯的物质的量分数为24%,C为标准状况下2.8mol气体(忽略水蒸汽),下列说法不正确的是( )

| A、乙池中溶液的pH变大 |
| B、E处通入H2,C处有O2放出 |
| C、甲池中阴极区只有苯被还原 |
| D、导线中共传导11.2mol电子 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:乙池装置是氢氧燃料电池,所以是原电池,原电池放电时,燃料失电子发生氧化反应,所以投放燃料的电极为负极,投放氧气的电极为正极,正极上氧气得电子发生还原反应,由于电解质溶液呈酸性,负极反应为:H2-2e-═2H+,正极反应为:O2+4e-+4H+═2H2O;该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-═2H2O+O2↑,所以E为负极,通入氢气,D为正极通入氧气,据此分析.
解答:
解:A、乙池装置是氢氧燃料电池,总反应方程式为:2H2+O2═2H2O,生成水电子酸性溶液被稀释,pH增大,故A正确;
B、阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-═2H2O+O2↑,所以E为负极,通入氢气,C处产生氧气,故B正确;
C、若参加反应的苯有10mol×24%-10mol×10%=1.4mol,甲池中阴极区苯放电的电极反应式为C6H6+6H++6e-=C6H12,1.4mol苯反应转移电子物质的量为1.4mol×6=8.4mol,所以甲池中阴极区不只有苯被还原,故C错误;
D、生成2.8mol氧气,据电极反应式4OH--4e-═2H2O+O2↑可知,转移电子物质的量为2.8mol×4=11.2mol,故D正确;
故选C.
B、阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-═2H2O+O2↑,所以E为负极,通入氢气,C处产生氧气,故B正确;
C、若参加反应的苯有10mol×24%-10mol×10%=1.4mol,甲池中阴极区苯放电的电极反应式为C6H6+6H++6e-=C6H12,1.4mol苯反应转移电子物质的量为1.4mol×6=8.4mol,所以甲池中阴极区不只有苯被还原,故C错误;
D、生成2.8mol氧气,据电极反应式4OH--4e-═2H2O+O2↑可知,转移电子物质的量为2.8mol×4=11.2mol,故D正确;
故选C.
点评:本题考查了氢氧燃料电池和电解池的相关知识,注意分析各电极反应,题目难度较大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
下列说法正确的是( )
| A、石油的分馏以及煤的干馏、气化、液化,都涉及到化学变化 |
| B、食用一定量的油脂能促进人体对某些维生素的吸收 |
| C、严重影响我国北方的霾尘,其颗粒物是胶体粒子 |
| D、合成纤维和光导纤维都是新型无机非金属材料 |
胶体区别于其它分散系的本质特征是( )
| A、分散质粒子直径在1nm~100nm之间 |
| B、产生丁达尔现象 |
| C、胶体的分散质能通过滤纸空隙,而浊液的分散质不能 |
| D、胶体在一定条件下能稳定存在 |
已知某溶液中只存在OH-、H+、Cl-、NH4+四种离子,其离子浓度可能有如下关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)②c(Cl-)>c(NH4+)>c(OH-)>c(OH+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)④c(NH4+)=c(Cl-)>c(OH-)=c(H+)
下列说法正确的是( )
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)②c(Cl-)>c(NH4+)>c(OH-)>c(OH+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)④c(NH4+)=c(Cl-)>c(OH-)=c(H+)
下列说法正确的是( )
| A、若①正确,则溶液中溶质一定为NH4Cl |
| B、若③正确,则溶液中c(NH3?H2O)+c(NH4+)>c(Cl-) |
| C、若④正确,且该溶液是由盐酸和氨水等体积混合而成,则盐酸中c(H+)等于氨水中c(OH-) |
| D、上述四种关系式均可能成立 |
下列反应的离子方程式正确的是( )
| A、铝与NaOH溶液反应:2Al+2 OH-+2H2O═2 AlO2-+3H2↑ |
| B、铁与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ |
| C、向AlCl3溶液中滴入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ |
| D、Na与水反应:Na+2H2O═Na++2OH-+H2↑ |