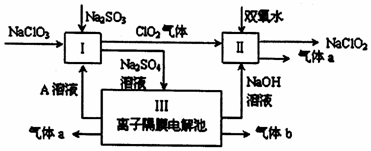
题目内容
17.向四支试管中分别加入少量不同溶液进行如下操作,结论正确的是( )| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 先滴加2滴KSCN溶液,再滴几滴新制的氯水 | 先不显红色,再滴新制的氯水后溶液变为红色 | 原溶液中有Fe2+ |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| D | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中 | 溶液变浑浊 | 原溶液中有 CO32- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.白色沉淀可能为AgCl;
B.先不显红色,可知不含铁离子,再滴几滴新制的氯水,变为血红色,可知亚铁离子被氧化为铁离子;
C.观察K的焰色反应需要透过蓝色的钴玻璃;
D.无色气体为二氧化碳或二氧化硫.
解答 解:A.白色沉淀可能为AgCl,则原溶液中可能含银离子或硫酸根离子,但二者不能同时存在,故A错误;
B.先不显红色,可知不含铁离子,再滴几滴新制的氯水,变为血红色,可知亚铁离子被氧化为铁离子,则原溶液中有Fe2+,故B正确;
C.观察K的焰色反应需要透过蓝色的钴玻璃,则由现象可知,原溶液中有Na+,不能确定是否含K+,故C错误;
D.无色气体为二氧化碳或二氧化硫,则原溶液中有CO32-或SO32-,或HCO3-等,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握离子的检验、发生的反应与现象为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
7.在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应:A(s)+2B(g)?C(g)+D(g)已达平衡状态的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | C. | C与D的浓度比 | D. | 气体总物质的量 |
8.m mo1乙炔跟n mo1氢气在密闭容器中反应,当其达到平衡时,生成p mol乙烯,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是( )
| A. | (3m+n)mol | B. | ($\frac{5}{2}$ m+$\frac{n}{2-3P}$)mol | C. | (3m+n+2p)mol | D. | ($\frac{5m}{2}$+$\frac{n}{2}$)mol |
12.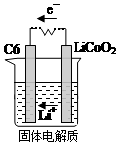 某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )
某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )
 某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )
某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )| A. | 阴极 | B. | 阳极 | C. | 负极 | D. | 正极 |
2.下列说法正确的是( )
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而增大有效碰撞的次数 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂不影响反应活化能但能增大单位体积内活化分子的百分数,从而增大反应速率 |
9.给下列溶液中通入CO2气体,不可能产生沉淀的是( )
| A. | 硅酸钠溶液 | B. | 氯化钙溶液 | C. | 氢氧化钙溶液 | D. | 碳酸钠饱和溶液 |
6.下列试剂不能贮存在磨口玻璃塞的试剂瓶里的是( )
| A. | 硫酸溶液 | B. | KOH溶液 | C. | 盐酸 | D. | 氯化钠溶液 |
7.等质量的铝分别投入等物质的量浓度等体积的盐酸和氢氧化钠溶液中,充分反应后下列情况不可能出现的是( )
| A. | 金属铝均剩余 | |
| B. | 金属铝均溶解 | |
| C. | 盐酸中铝剩余,而氢氧化钠中铝全部溶解 | |
| D. | 氢氧化钠这铝剩余,而盐酸中铝全部溶解 |