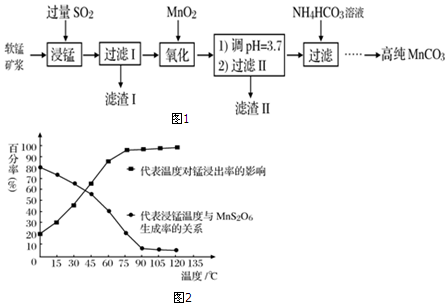
题目内容
16.下列实验不能作为判断依据的是( )| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | 比较Mg(OH)2与Al(OH)3的碱性强弱,判断镁与铝的金属性强弱 | |
| C. | 往硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | 根据HF和HCl的水溶液的酸性强弱判断氟与氯的非金属性的强弱 |
分析 A、金属与水反应置换出氢气的难易程度,能判断金属性的强弱;
B、碱的碱性越强,对应金属性越强;
C、强酸制弱酸,往硅酸钠溶液中通入CO2产生白色沉淀,说明碳酸的酸性强于硅酸的酸性;
D.应用最高价氧化物的酸性强弱比较.
解答 解:A、钠与冷水比镁与冷水反应剧烈,因此钠的金属性强于镁,故A正确;
B、金属性越强,对应碱的碱性越强,镁的金属性强于铝,则碱性强弱:Mg(OH)2>Al(OH)3,故B正确;
C、强酸制弱酸,往硅酸钠溶液中通入CO2产生白色沉淀,说明碳酸的酸性强于硅酸的酸性,故C正确;
D.氢氟酸是弱酸,而盐酸是强酸,但是氟的非金属性要比氯的非金属性强,故D错误.
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及非金属性、金属性强弱判断及酸性强弱判断,明确物质的性质是解本题关键,知道金属性、非金属性强弱判断方法,题目难度不大.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
6.下列关于物质性质变化的比较,不正确的是( )
| A. | 酸性强弱:HClO4>H2SO4>H3PO4>H2SiO3 | |
| B. | 原子半径大小:K>Na>S>O | |
| C. | 稳定性:NH3>PH3>AsH3 | |
| D. | 还原性强弱:F->Cl->Br |
4.为除去括号内的杂质,下列所选用试剂和方法均正确的是( )
| A. | Na2CO3溶液(NaHCO3),加热 | |
| B. | 铁粉(铝粉):加入过量的氨水后过滤 | |
| C. | NaCl溶液(Na2SO4):加入适量的硝酸钡后过滤 | |
| D. | 淀粉溶液(KCl):通过半透膜进行渗析 |
11.下列物质在变化过程中,只需克服分子间作用力的是( )
| A. | 食盐溶化 | B. | 干冰升华 | ||
| C. | 氯化铵受热,固体消失 | D. | 石墨熔化 |
8.二甲醚(CH3OCH3)-空气燃料电池的工作原理如图所示.电池工作时,下列说法正确的是( )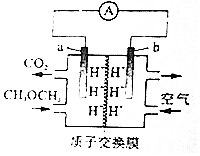

| A. | a极区域溶液的pH变大 | |
| B. | b极有H2O生成 | |
| C. | a极反应式:CH3OCH3+3O2--12e-═2CO2↑+6H+ | |
| D. | 每消耗11.2LO2(标准状况).有2molH+向左侧移动 |
5.将0.08mol的M、N(N的相对分子质量大于M)两种饱和一元醛的混合物,与足量的新制氢氧化铜悬浊液共热,可生成14.4g砖红色沉淀,下列说法正确的是( )
| A. | M可能是甲醛,也可能是乙醛 | |
| B. | 混合物中必有乙醛,其物质的量为0.06mol | |
| C. | 不能判断出N是何种醛,但其物质的量是0.06mol | |
| D. | M一定是甲醛,N一定是丙醛,其物质的量之比为1:3 |
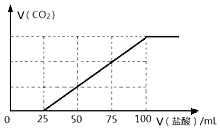 向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.
向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.