题目内容
(1)0.3mol气态高能燃料乙硼烷(分子式B2H6),在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,则其热化学方程式为 .
(2)又已知:H2O(g)=H2O(l);△H=-44kJ/mol,则5.6L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是 .
(2)又已知:H2O(g)=H2O(l);△H=-44kJ/mol,则5.6L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是
考点:有关反应热的计算,热化学方程式
专题:化学反应中的能量变化
分析:(1)根据热化学方程式的书写方法可知,物质的物质的量与反应放出的热量成正比,并注意标明各物质的聚集状态来解答;
(2)先根据盖斯定律写出方程式,然后根据物质的物质的量与反应放出的热量成正比来解答.
(2)先根据盖斯定律写出方程式,然后根据物质的物质的量与反应放出的热量成正比来解答.
解答:
解:(1)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,反应的热化学方程式为B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165kJ/mol,
故答案为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165kJ/mol;
(2)B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165kJ/mol; ①
H2O(l)→H2O(g);△H=+44kJ/moL,②
①+②×3得:B2H6(g)+3O2(g)=B2O3(s)+3H2O(g)△H=-2033kJ/mol,
5.6L(标准状况)即0.25mol乙硼烷完全燃烧生成气态水时放出的热量是为2033kJ×0.25=508.25kJ;
故答案为:508.25kJ.
故答案为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165kJ/mol;
(2)B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165kJ/mol; ①
H2O(l)→H2O(g);△H=+44kJ/moL,②
①+②×3得:B2H6(g)+3O2(g)=B2O3(s)+3H2O(g)△H=-2033kJ/mol,
5.6L(标准状况)即0.25mol乙硼烷完全燃烧生成气态水时放出的热量是为2033kJ×0.25=508.25kJ;
故答案为:508.25kJ.
点评:本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,题目难度不大.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
下列实验方案合理的是( )
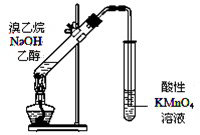

| A、鉴别苯和甲苯:分别加入溴水振荡 |
| B、检验酒精中的少量水:向酒精中加入无水硫酸铜 |
| C、制备纯净的氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 |
| D、证明溴乙烷与NaOH醇溶液共热生成乙烯:用如图所示的实验装置 |
12.8g铜跟适量的浓硝酸反应,铜完全作用后,共收集到气体5.6L(标准状况),反应消耗HNO3的物质的量可能是( )
| A、0.25mol |
| B、1.0mol |
| C、0.65mol |
| D、0.5mol |
下列物质的熔点高低顺序正确的是( )
| A、金刚石>碳化硅>晶体硅 |
| B、氧化铝>氯化钾>氯化钠 |
| C、H2O>NH3>PH3>AsH3 |
| D、SiC>生铁>纯铁>Mg |