��Ŀ����
2��A��B��C��D����Ԫ�ص�ԭ���������ε�����A��B�Ļ�̬ԭ����L��δ�ɶԵ������ֱ�Ϊ3��2��C�ڶ���������Ԫ���е縺����С��DԪ�ر���Ϊ��������֮��ĵ�����������Ͻ�����ں��칤ҵ������Ϊ��21���͵Ľ����������̬ԭ����Χ����ռ�������ܼ��Ҹ��ܼ���������ȣ���ش��������⣺��1��A��B��C����Ԫ�صĵ�һ��������С�����˳����Na��O��N����Ԫ�ط��ţ���
��2��DԪ�ػ�̬ԭ�ӵĺ�������Ų�ʽΪ[Ar]3d24s2��
��3����ɫ����C3AB4�������ӵĿռ����幹�����������壬����ԭ�ӵ��ӻ���ʽ��sp3
��4����ѧ��ѧ����������A2B��Ϊ�ȵ�����ķ�����CO2��CS2����дһ�ּ��ɣ���
��5����֪D3+���γ���λ��Ϊ6������������ɽ�ΪDCl3•6H2O�����־��壬һ��Ϊ��ɫ����һ��Ϊ��ɫ��Ϊ�ⶨ���־���Ľṹ���ֱ�ȡ������Ʒ��������ʵ�飺�ٽ��������ˮ��Һ���ڵμ�����AgNO3��Һ���۹��˳�AgCl����������ϴ�ӡ������������ʵ���ò����ij�����������ɫ��������ɫ�����$\frac{2}{3}$��
���ݲⶨ�����֪��ɫ����Ļ�ѧʽΪ[TiCl��H2O��5]Cl2•H2O���þ����к��еĻ�ѧ����abd
a�����Ӽ� b�����Լ� c���Ǽ��Լ� d����λ����
���� A��B��C��D����Ԫ�ص�ԭ���������ε�����A��BԪ�صĻ�̬ԭ��L���Ӳ���ĩ�ɶԵ������ֱ�Ϊ3��2����Aԭ�Ӻ�������Ų�ʽΪ1s22s22p3��AΪ��Ԫ�أ�B��ԭ���������ڵ�Ԫ�أ���Bԭ�Ӻ�������Ų�ʽΪ1s22s22p4��BΪ��Ԫ�أ�����������Ԫ����CԪ�صĵ縺����С����CΪNaԪ�أ�DԪ�ر���Ϊ��������֮��ĵ�����������Ͻ�����ں��칤ҵ������Ϊ��21���͵Ľ����������̬ԭ����Χ����ռ�������ܼ��Ҹ��ܼ���������ȣ���DΪTiԪ�أ����Ԫ���������Լ���ĿҪ������⣮
��� �⣺��1����Ԫ��ԭ��2p�ܼ�����3�����ӣ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ���Ͻ�����Խǿ��һ������ԽС�����һ��������С�����˳����Na��O��N���ʴ�Ϊ��Na��O��N��
��2��DΪTiԪ�أ���������Ų�ʽΪ[Ar]3d24s2���ʴ�Ϊ��[Ar]3d24s2��
��3���ð�ɫ����ΪNa3NO4��NO43-������Nԭ�Ӽ۲���Ӷ���=4+$\frac{5+3-2��4}{2}$=4��Nԭ��û�й¶Ե��ӣ�����Ϊ��������ṹ��Nԭ�Ӳ�ȡsp3�ӻ���
�ʴ�Ϊ���������壻sp3��
��4��A2BΪN2O���۵���Ϊ16������3��ԭ�ӣ����Ӧ�ĵȵ�����ΪCO2 ��CS2���ʴ�Ϊ��CO2 ��CS2��
��5��Ti3+����λ����Ϊ6����������Һ�е���AgNO3��Һ����������ɫ��������������������������磬���ݳ�������ϴ�Ӹ�������������ԭ��ɫ�����ˮ��Һ��AgNO3��Һ��Ӧ�õ��İ�ɫ��������Ϊ��ɫ�����ˮ��Һ��Ӧ�õ�����������$\frac{2}{3}$����֪��ɫ�����к�3�������ӣ���ɫ�����к�2�������ӣ�����ɫ����Ļ�ѧʽΪ[TiCl��H2O��5]Cl2•H2O���������Ӽ������Լ�����λ����
�ʴ�Ϊ��[TiCl��H2O��5]Cl2•H2O��abd��
���� �������ʽṹ�����ʣ�Ϊ�߿��������ͣ���Ŀ�漰��������Ų��������ܡ��ӻ���������ṹ���ȵ����塢�����ȣ��ƶ�Ԫ���ǽ���ؼ���ע�����յȵ�����ĸ��ע����������ڽ�������������ӵ������Ѷ��еȣ�

 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�| A�� | ��ѧ��Ӧ���ʣ�4v����O2��=5v����NO�� | |
| B�� | NH3��O2��NO��H2O�ķ��Ӹ�������4��5��4��6 | |
| C�� | ��λʱ��������4 mol NO��ͬʱ����6 mol H2O | |
| D�� | ��Ӧ�������NH3������������ٸı� |
��1������β���к���CO��NO2���ж����壬��������װβ������װ�ã���ʹ�ж�����ת��Ϊ�����壮
4CO��g��+2NO2��g��?4CO2��g��+N2��g����H=-1200kJ•mol-1
���ڸ÷�Ӧ���¶Ȳ�ͬ��T2��T1��������������ͬʱ����ͼ1ͼ����ȷ�����ң�����ţ���
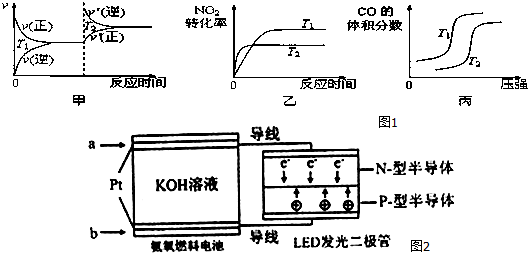
��2���û���̿��ԭ��Ҳ���Դ����������ij�о�С����ij�ܱ���������һ�����Ļ���̿��NO��������ӦC��s��+2NO��g��?N2��g��+CO2��g����H��T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ���Ũ�������
ʱ��/min Ũ��/��mol/L�� | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
��30min��ֻ�ı�ijһ�����������ϱ��������жϸı������������bc������ĸ���ţ���
a������һ�����Ļ���̿ b��ͨ��һ������NO
c���ʵ���С��������� d��������ʵĴ���
����30min�������¶���T2�棬�ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ5��3��3����ﵽ��ƽ��ʱNO��ת���ʽ��ͣ�����ߡ����͡�������H��0���������������
��3����CO2��NH3Ϊԭ�Ͽɺϳɻ�������[��ѧʽΪCO��NH2��2]����֪��
��2NH3��g��+CO2��g��=NH2CO2NH4��s����H=-l59.5kJ/mol
��NH2CO2NH4��s��=CO��NH2��2��s��+H2O��g����H=+116.5kJ/mol
��H2O��l��=H2O��g����H=+44.0kJ/mol
д��CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ2NH3��g��+CO2��g��=CO��NH2��2��s��+H2O��l����H=-87.0 kJ•mol-1��
��4��һ�ְ�ȼ�ϵ�أ�ʹ�õĵ������Һ��2mol/L��KOH��Һ��
��ط�ӦΪ��4NH3+3O2=2N2+6H2O��
��д��ͨ��ͼ2��a����һ���ĵ缫��ӦʽΪ2NH3+6OH--6e-=N2+6H2O��ÿ����3.4g NH3ת�Ƶ��ӵ����ʵ���Ϊ0.6mol��
��1����֪��
| ��ѧʽ | H2��g�� | CO��g�� | CH3OH��l�� |
| ��ȼ���ȣ�25�棩 ��H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
��2�����ݻ��ɱ���ܱ������г���1mol CO �� g �� ��2molH2 �� g ������CH3OH�� g ����H2��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ1��ʾ��
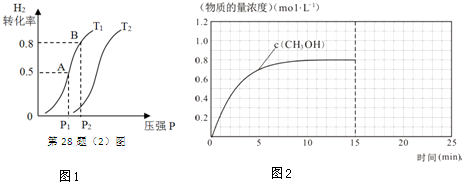
�ٸ÷�Ӧ�ġ�S��0��ͼ�е�T1��T2�����������������=������
�ڵ��ﵽƽ��״̬A ʱ�����������Ϊ2L����ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ4�����ﵽƽ��״̬B ʱ�������������V��B��=0.4L��
���ڸ������У����д�ʩ�����Ӽ״����ʵ���B��
A�������¶� B����ƽ����ϵ�м�ʱ����CH3OH
C������He D���ٳ���0.5mol CO��1mol H2
��3�����ݻ��̶�Ϊ2L���ܱ������г���2molCO�� g ����6molH2�� g ������CH3OH�� g ������Ӧʱ�������ʵ���Ũ�ȵĹ�ϵ��ͼ2��ʾ����ǰ10�����ڣ�������ƽ����Ӧ����Ϊ0.16mol•L-1•min-1����15����ʱ������ϵ�¶ȣ���20����ʱ�ﵽ��ƽ�⣬��ʱ������ת����Ϊ33.3%������ͼ2�л���15-25����c ��CO���ı仯���ߣ�
| A�� | 1 mol H2���6.02��1023��H | B�� | 1 mol������6.02��1023��O2 | ||
| C�� | 1 mol CaCl2��Һ�ﺬ��1 mol���� | D�� | 1 mol H+�к���H+��ΪNA |
 ��NaCl��Ϊԭ���Ʊ�KClO4�Ĺ������£�
��NaCl��Ϊԭ���Ʊ�KClO4�Ĺ������£�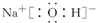 ��
�� ��
�� �������״������ʵ����ȼ�ϣ�������ȼ�ϵ�أ�
�������״������ʵ����ȼ�ϣ�������ȼ�ϵ�أ�