题目内容
X、Y、Z、W为1~18号中的四种元素,其最高正价依次为+1、+4、+5、+7,核电荷数按照Y、Z、X、W的顺序增大.已知Y与Z的原子次外层的电子数均为2,W、X的原子次外层的电子数为8.
(1)写出元素的名称:X ,Z .
(2)画出它们的原子结构示意图:Y ,W .
(3)写出X的最高价氧化物与Z的最高价氧化物对应水化物反应的化学方程式 .
(4)按碱性减弱,酸性增强的顺序排出各元素最高价氧化物对应水化物的化学式: 、 、 、 .
(1)写出元素的名称:X
(2)画出它们的原子结构示意图:Y
(3)写出X的最高价氧化物与Z的最高价氧化物对应水化物反应的化学方程式
(4)按碱性减弱,酸性增强的顺序排出各元素最高价氧化物对应水化物的化学式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,则X、Y、Z、W分别位于第ⅠA族、ⅣA族、ⅤA族、ⅦA族;
核电荷数按照Y、Z、X、W的顺序增大,由于Y与Z的原子次外层的电子数为2,说明Y、Z含有两个电子层,则Y为C元素、Z为N元素;
W、X原子次外层电子数为8,则W为Cl元素、X为Na元素,以此解答该题.
核电荷数按照Y、Z、X、W的顺序增大,由于Y与Z的原子次外层的电子数为2,说明Y、Z含有两个电子层,则Y为C元素、Z为N元素;
W、X原子次外层电子数为8,则W为Cl元素、X为Na元素,以此解答该题.
解答:
解:(1)X、Y、Z、W为短周期的元素,且其最高正价依次为+1、+4、+5、+7,则X、Y、Z、W分别位于第ⅠA族、ⅣA族、ⅤA族、ⅦA族.核电荷数按照Y、Z、X、W的顺序增大,由于Y与Z的原子次外层的电子数为2,则Y为C元素、Z为N元素;W、X原子次外层电子数为8,则W为Cl元素、X为Na元素,
根据分析可知,X为Na元素,元素名称为钠;Z为N元素,元素名称为氮,
故答案为:钠;氯;
(2)Y为C元素,质子数为6,核外电子数为6,有2个电子层,最外层4个电子,原子结构示意图为: ;
;
W为Cl元素,质子数为17,核外电子数为17,有3个电子层,最外层7个电子,原子结构示意图为: ,
,
故答案为: ;
; ;
;
(3)X的最高价氧化物对应的水化物为NaOH,Z的最高价氧化物对应的水化物为HNO3,二者反应生成硝酸钠和水,反应的化学方程式为:NaOH+HNO3=NaNO3+H2O,
故答案为:NaOH+HNO3=NaNO3+H2O;
(4)X的最高价氧化物对应的水化物为NaOH,Y的最高价氧化物对应的水化物为H2CO3,Z的最高价氧化物对应的水化物为HNO3,W的最高价氧化物对应的水化物为HClO4,
金属性越强,最高价氧化物对应的水化物碱性越强,非金属性越强,最高价氧化物对应的水化物酸性越强,所以碱性减弱、酸性增强的顺序为NaOH、H2CO3、HNO3、HClO4,
故答案为:NaOH;H2CO3;HNO3;HClO4.
根据分析可知,X为Na元素,元素名称为钠;Z为N元素,元素名称为氮,
故答案为:钠;氯;
(2)Y为C元素,质子数为6,核外电子数为6,有2个电子层,最外层4个电子,原子结构示意图为:
 ;
;W为Cl元素,质子数为17,核外电子数为17,有3个电子层,最外层7个电子,原子结构示意图为:
 ,
,故答案为:
 ;
; ;
;(3)X的最高价氧化物对应的水化物为NaOH,Z的最高价氧化物对应的水化物为HNO3,二者反应生成硝酸钠和水,反应的化学方程式为:NaOH+HNO3=NaNO3+H2O,
故答案为:NaOH+HNO3=NaNO3+H2O;
(4)X的最高价氧化物对应的水化物为NaOH,Y的最高价氧化物对应的水化物为H2CO3,Z的最高价氧化物对应的水化物为HNO3,W的最高价氧化物对应的水化物为HClO4,
金属性越强,最高价氧化物对应的水化物碱性越强,非金属性越强,最高价氧化物对应的水化物酸性越强,所以碱性减弱、酸性增强的顺序为NaOH、H2CO3、HNO3、HClO4,
故答案为:NaOH;H2CO3;HNO3;HClO4.
点评:本题考查元素周期表和周期律知识,题目难度中等,根据题干信息及所学知识正确推断元素的种类为解答该题的关键,注意掌握原子结构与元素周期表结构、元素周期律的递变规律的关系.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
下列化学式与指定物质的主要成分对应正确的是( )
| A、Fe2O3--磁性氧化铁 |
| B、CaO--生石灰 |
| C、NaHCO3--纯碱 |
| D、CuSO4--胆矾 |
下列有关问题,与盐类的水解无关的是( )
| A、NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 |
| B、盐酸可作铁制品的除锈剂 |
| C、实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 |
| D、加热蒸干AlCl3溶液得到Al(OH)3固体 |
短周期金属元素甲~戊在周期表中的相对位置如下表所示,下面判断不正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A、原子半径:丙<丁<戊 |
| B、金属性:甲<丙 |
| C、氢氧化物碱性:丙>丁>戊 |
| D、最外层电子数:甲>乙 |
下列溶液中,由水电离出的c(H+)<10-7mol?L-1的是( )
| A、25℃时,0.01mol?L-1NH4Cl溶液 |
| B、25℃时,0.01mol?L-1NaHSO4溶液 |
| C、100℃时,0.01mol?L-1NaNO3溶液 |
| D、25℃时,0.01mol?L-1NaF溶液 |
四个试管中都装有5mL 0.1mol?L-1 Na2S2O3溶液,分别在不同温度下加入硫酸和一定量水,最先出现浑浊的是( )
| A、20℃,10 mL 0.1mol?L-1硫酸 |
| B、20℃,5 mL 0.1 mol?L-1硫酸和5 mL水 |
| C、30℃,10 mL 1 mol?L-1硫酸 |
| D、30℃,5 mL 1 mol?L-1硫酸和5 mL水 |
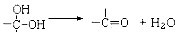
 (1)根据氢元素最高正价最低负价的绝对值相等,有人提议把氢元素放在周期表中的ⅣA族.那么根据NaH的存在,又可把氢元素放在
(1)根据氢元素最高正价最低负价的绝对值相等,有人提议把氢元素放在周期表中的ⅣA族.那么根据NaH的存在,又可把氢元素放在