题目内容
7.下列有关化学反应速率的认识,正确的是( )| A. | 增大压强(对于气体反应),活化分子总数必然增大,故反应速率增大 | |
| B. | 温度升高,分子动能增加,减小了活化能,故反应速率增大 | |
| C. | 选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大 | |
| D. | H+和OH-的反应活化能非常小,反应几乎在瞬间完成 |
分析 A.对反应前后气体体积不变的反应,增大压强活化分子总数不变;
B.活化能是活化分子最低能量与反应分子的平均能量的差值,对于同一分子活化能是定值,升高温度活化能不改变.
C.使用催化剂降低活化能,提高反应速率;
D.酸和碱反应不需要外界做功的条件下就能发生,说明它们已经处于活跃状态,因此活化能非常小.
解答 解:A.反应前后气体体积不变的反应,增大压强,体积减小,活化分子总数不变,但活化分子浓度增大,反应速率增大,故A错误;
B.温度升高,更多分子吸收能量成为活化分子,反应速率增大,活化能不变,故B错误;
C.使用催化剂,降低活化能,使更多分子成为活化分子,反应速率增大,故C错误;
D.酸和碱反应不需要外界做功的条件下就能发生,说明它们已经处于活跃状态,因此活化能非常小,故D正确;
故选D.
点评 本题考查了化学反应速率的影响因素的判断和应用,题目难度不大,主要考查压强、温度、催化剂扥因素对平衡的影响,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
18.某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态):
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大2~3min
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)0.1mol/(L•min).
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液:
A.蒸馏水B.NaCl溶液C.Na2CO3 溶液D.CuSO4溶液你认为可行的是(填编号)AB.
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)0.1mol/(L•min).
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液:
A.蒸馏水B.NaCl溶液C.Na2CO3 溶液D.CuSO4溶液你认为可行的是(填编号)AB.
15.下列有关化学用语表示正确的是( )
| A. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl | |
| B. | 14C的原子结构示意图: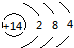 | |
| C. | N2分子的电子式: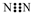 | |
| D. | 乙酸乙酯的结构简式为:CH3COOC2H5 |
12.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
请回答:
(1)以上元素中,最高价氧化物对应水化物酸性最强的是HClO4;碱性最强的是KOH;显两性的是Al(OH)3(填化学式)
(2)③、④、⑨三种元素按原子半径由大到小的顺序依次为K>Na>Mg(填元素符号)
(3)按要求写出下列两种物质的电子式:⑥的氢化物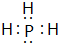 ; ⑨的最高价氧化物的对应的水化物
; ⑨的最高价氧化物的对应的水化物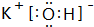 ;
;
(4)由H和①形成的原子数之比为1:1的物质H2O2 (填化学式).
(5)利用⑧的单质制备漂白粉发生反应的化学方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O.
(6)⑤的最高价氧化物对应的水化物既能与③的最高价氧化物对应的水化物反应,也能与⑧的最高价氧化物对应的水化物反应.分别写出其反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;Al(OH)3+3H+=Al3++3H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ |
(1)以上元素中,最高价氧化物对应水化物酸性最强的是HClO4;碱性最强的是KOH;显两性的是Al(OH)3(填化学式)
(2)③、④、⑨三种元素按原子半径由大到小的顺序依次为K>Na>Mg(填元素符号)
(3)按要求写出下列两种物质的电子式:⑥的氢化物
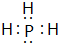 ; ⑨的最高价氧化物的对应的水化物
; ⑨的最高价氧化物的对应的水化物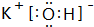 ;
;(4)由H和①形成的原子数之比为1:1的物质H2O2 (填化学式).
(5)利用⑧的单质制备漂白粉发生反应的化学方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O.
(6)⑤的最高价氧化物对应的水化物既能与③的最高价氧化物对应的水化物反应,也能与⑧的最高价氧化物对应的水化物反应.分别写出其反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;Al(OH)3+3H+=Al3++3H2O.
19.用价层电子对互斥理论预测H2S和PCl3的立体结构,两个结论都正确的是( )
| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
16.有关化学键的说法正确的是( )
| A. | 全部由非金属元素构成的化合物一定是共价化合物 | |
| B. | 某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键 | |
| C. | 金属与非金属原子间只能形成离子键 | |
| D. | 含有共价键的化合物不一定是共价化合物 |
17.某工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).下列对该产品的描述不正确的是( )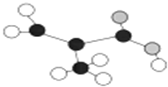

| A. | 官能团为碳碳双键、羧基 | B. | 与CH2=CHCOOCH3互为同分异构体 | ||
| C. | 能发生取代、加成和氧化反应 | D. | 分子中所有原子可能在同一平面 |
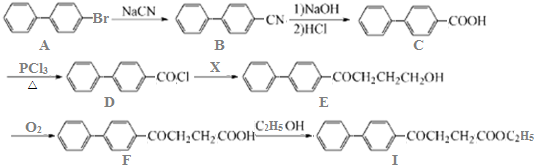
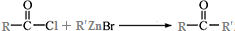
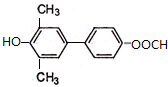 .
.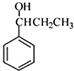 )为强效利胆药,请写出以甲苯和C2H5ZnBr为原料制备苯丙醇的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:
)为强效利胆药,请写出以甲苯和C2H5ZnBr为原料制备苯丙醇的合成路线流程图(无机试剂可任选).合成路线流程图示例如下: