��Ŀ����
18���Ӵ��������Ṥ���У�������Ӧ��450�沢�д��������½��У�2SO2��g��+O2��g��?������2SO3��g������H=-190kJ•mol-1��1����һ���̶��ݻ�Ϊ5L���ܱ������г���0.20mol SO2��0.10molO2������Ӻ�ﵽƽ�⣬��������к�SO30.8g����V��O2��=0.002mol•L-1•min-1�������ʱ��ѧƽ�ⳣ��K1=100��
��2�����¶Ȳ��䣬����ͨ��0.20mol SO2��0.10mol SO3����ƽ���ƶ�����ԭ����������Ӧ�����ƶ�����Ϊ��ʱ��Ũ����Ϊ4.2������ƽ�ⳣ������ƽ���ѧƽ�ⳣ��ΪK2����K1��K2֮��Ĺ�ϵΪ=�����������������=������
��3������ֻ�ܱ�����A��B��A�ܱ��ֺ��ݣ�B�ܱ��ֺ�ѹ����ʼʱ���ݻ���ȵ�A��B�зֱ�ͨ�������Ϊ2��1�ĵ�����SO2��O2��ʹ֮������Ӧ�������=���������ң�����С�����䣩��
�ٴﵽƽ������Ҫ��ʱ�䣺t��A����t��B��
��ƽ��ʱ��SO2��ת���ʣ�a��A����a ��B��
�۴ﵽƽ��ʱ�����������зֱ�ͨ�������Ar����B�еĻ�ѧƽ������Ӧ�����ƶ���A�еĻ�ѧ��Ӧ���ʲ��䣮
���� ��1����һ���̶��ݻ�Ϊ5L���ܱ������г���0.20mol SO2��0.10molO2�����������Ũ��=$\frac{0.20mol}{5L}$=0.04mol/L������Ũ��=$\frac{0.10mol}{5L}$=0.02mol������Ӻ�ﵽƽ�⣬��������к�SO30.8g��n��SO3��=$\frac{0.8g}{80g/mol}$=0.01mol��ƽ��Ũ��Ϊ$\frac{0.01mol}{5L}$=0.002mol/L����ϻ�ѧƽ������ʽ��ʽ���㣬
2SO2��g��+O2��g��?2SO3��g��
��ʼ����mol/L�� 0.04 0.02 0
�仯����mol/L�� 0.002 0.001 0.002
ƽ������mol/L�� 0.038 0.019 0.002
��Ӧ����V=$\frac{��c}{��t}$��ƽ�ⳣ��K=$\frac{������ƽ��Ũ���ݴη��˻�}{��Ӧ��ƽ��Ũ���ݴη��˻�}$��
��2�����¶Ȳ��䣬����ͨ��0.20mol SO2��0.10mol SO3������Ũ���̺�ƽ�ⳣ���Ƚ�ƽ����Ӧ���еķ���ƽ�ⳣ��ֻ���¶ȱ仯��
��3����A�ܱ��ֺ��ݣ�B�ܱ��ֺ�ѹ����ʼʱ���ݻ���ȵ�A��B�зֱ�ͨ�������Ϊ2��1�ĵ�����SO2��O2��ʹ֮������Ӧ��2SO2+O2?2SO3�����º����淴Ӧ����ѹǿ��С���ʼ��������º�ѹ�����з�Ӧ������ѹǿ����Ӧ���ʴ�
�ں��º����淴Ӧ����ѹǿ��С���ʼ��������º�ѹ�����з�Ӧ������ѹǿ����Ӧ���ʴ�ת���ʴ�
�ۺ��º����������������ѹ����ѹ���䣬ƽ�ⲻ������Ӧ���ʲ��䣻���º�ѹ�������������ѹǿ��С��ƽ���������������ķ�����У�
��� �⣺��1����һ���̶��ݻ�Ϊ5L���ܱ������г���0.20mol SO2��0.10molO2�����������Ũ��=$\frac{0.20mol}{5L}$=0.04mol/L������Ũ��=$\frac{0.10mol}{5L}$=0.02mol������Ӻ�ﵽƽ�⣬��������к�SO30.8g��n��SO3��=$\frac{0.8g}{80g/mol}$=0.01mol��ƽ��Ũ��Ϊ$\frac{0.01mol}{5L}$=0.002mol/L����ϻ�ѧƽ������ʽ��ʽ���㣬
2SO2��g��+O2��g��?2SO3��g��
��ʼ����mol/L�� 0.04 0.02 0
�仯����mol/L�� 0.002 0.001 0.002
ƽ������mol/L�� 0.038 0.019 0.002
�����ķ�Ӧ����V=$\frac{��c}{��t}$=$\frac{0.001mol/L}{0.5min}$=0.002mol/L•min��
ƽ�ⳣ��K=$\frac{������ƽ��Ũ���ݴη��˻�}{��Ӧ��ƽ��Ũ���ݴη��˻�}$=$\frac{0.00{2}^{2}}{0.03{8}^{2}��0.019}$=0.146��
�ʴ�Ϊ��0.002��0.146��
��2�����¶Ȳ��䣬����ͨ��0.20mol SO2��0.10mol SO3�������������ʵ���Ũ��c��SO2��=0.038mol/L+$\frac{0.20mol}{5L}$=0.078mol/L��c��O2��=0.019mol/L��c��SO3��=0.002mol/L+$\frac{0.10mol}{5L}$=0.022mol/L��Qc=$\frac{0.02{2}^{2}}{0.07{8}^{2}��0.019}$=4.2��K=0.146����Ӧ������У��¶Ȳ���ﵽƽ��״̬ʱƽ�ⳣ�����䣬��K1��K2֮��Ĺ�ϵΪ��ͬ��
�ʴ�Ϊ��������Ӧ�����ƶ�����Ϊ��ʱ��Ũ����Ϊ4.2������ƽ�ⳣ����=��
��3����A�ܱ��ֺ��ݣ�B�ܱ��ֺ�ѹ����ʼʱ���ݻ���ȵ�A��B�зֱ�ͨ�������Ϊ2��1�ĵ�����SO2��O2��ʹ֮������Ӧ��2SO2+O2?2SO3�����º����淴Ӧ����ѹǿ��С���ʼ��������º�ѹ����B�з�Ӧ������ѹǿ����Ӧ���ʴ����Դﵽƽ������Ҫ��ʱ��AС��B��
�ʴ�Ϊ������
����ʼ�������������Ũ����ͬ����Ӧ������ͬ��������AΪ���º��������е�ѹǿС��B���º�ѹ��������Ӧ����B��A����������ת����A��B��
�ʴ�Ϊ������
�ۺ��º���B�������������ѹ����ѹ���䣬ƽ�ⲻ������Ӧ���ʲ��䣻���º�ѹA�������������ѹǿ��С��ƽ���������������ķ�����У���Ӧ�����������С�ķ�Ӧ������ƽ��������У�
�ʴ�Ϊ�����䣮
���� ���⿼���˺��º�ѹ�����º��������л�ѧƽ���Ӱ�����ط����жϣ���Ŀ�Ѷ��еȣ�

 ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д� �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д� ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д� �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д���
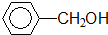 ����-OH
����-OH��
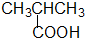 ������-COOH
������-COOH��
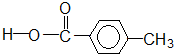 ȩ��
ȩ��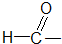
��CH3-O-CH3 ����
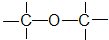
��
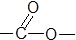
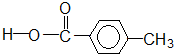 ����
����
| A�� | �٢ڢۢܢ� | B�� | �ڢ� | C�� | �ڢۢ� | D�� | �ڢܢ� |
| A�� | �����л�����ϩ��ͨ��ʢ������KMnO4��Һ��ϴ��ƿϴ����ȥ��ϩ | |
| B�� | ����C2H5Cl����ԭ��ʱ����C2H5Cl��NaOH��Һ��ϼ��Ⱥ��ȼ���ϡ�����ữ���ٵμ���������Һ | |
| C�� | ����ˮ�Ҵ���ŨH2SO4������140������Ƶ���ϩ���� | |
| D�� | ʵ������ȡ��Ȳʱ�����ñ���ʳ��ˮ����ˮ |

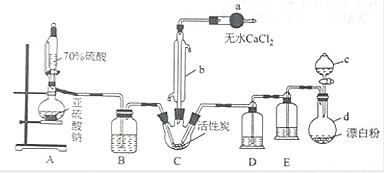 �Ȼ����Ǻϳ������ȣ�SO2Cl2���ij��÷�����ʵ���Һϳ������ȣ�SO2Cl2����ʵ��װ����ͼ��ʾ��
�Ȼ����Ǻϳ������ȣ�SO2Cl2���ij��÷�����ʵ���Һϳ������ȣ�SO2Cl2����ʵ��װ����ͼ��ʾ��