题目内容
7.铁及其化合物在国民经济的发展中起着重要作用.(1)铁在潮湿的空气中易发生电化学腐蚀.某同学将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图1所示.液滴边缘是--区(填“正极”或“负极”),其电极反应式为O2+2H2O+4e-=4OH-.
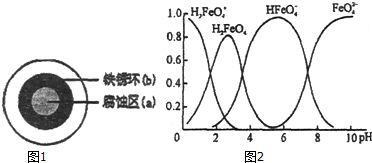
(2)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有;
①2TiO2+(无色)+Fe+4H+═2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O═TiO2+(无色)+Fe2++2H+
③2Fe3++Fe=3Fe2+.
(3)高铁酸钠(Na2FeO4)是一种优良的水处理剂.
①FeO42-在水溶液中的存在形态如图2所示,纵坐标表示各存在形态的分数分布.下列说法不正确的是AB(填字母序号).
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-═FeO42-+H2O
②从环境保护的角度看,制备高铁酸盐的较好方法为电解法.用铁片作阳极,NaOH溶液为电解质溶液,电解制备高铁酸钠,其电流效率可达到40%.写出阳极的电极反应式Fe-6e-+8OH-=FeO42-+4H2O
Fe-6e-+8OH-=FeO42-+4H2O.铁丝网电极是更理想的阳极材料,相同条件下,可将电流效率提高至70%以上,原因是铁丝网的接触面积更大.
若维持电流强度为5.0A,电解20min,理论上可生成Na2FeO41.7g.(己知:F=96500C/mol,答案保留两位有效数字)
分析 (1)铁在中性条件下发生吸氧腐蚀,铁作负极,碳作正极,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应;
(2)铁离子具有氧化性,铁能和铁离子发生氧化还原反应;
(3)①A.根据图象知,不论溶液酸碱性如何变化,酸性条件下,高铁酸根离子不存在;
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数先增大后减小;
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-═FeO42-+H2O;
②阳极铁失去电子,生成高铁酸盐,电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O;铁丝网接触面积增大,加快反应速率,所以电流效率提高至70%以上;结合Q=It,F=96500C/mol,计算电子转移物质的量,依据化学方程式电量关系计算得到Na2FeO4物质的量,得到质量.
解答 解:(1)铁在中性条件下发生吸氧腐蚀,铁作负极,碳作正极,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应生成氢氧根离子,氢氧根离子和亚铁离子反应生成氢氧化亚铁,氢氧化亚铁不稳定被氧化生成氢氧化铁,所以边缘是正极,正极上电极反应式为:O2+2H2O+4e-=4OH-,故答案为:正极,O2+2H2O+4e-=4OH-;
(2)铁和铁离子发生氧化还原反应生成亚铁离子,离子反应方程式为:2Fe3++Fe=3 Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(3)①A.根据图象知,不论溶液酸碱性如何变化,酸性条件下,高铁酸根离子不存在,故错误;
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数先增大后减小,故错误;
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-═FeO42-+H2O,故正确;
故选AB;
②阳极铁失去电子,生成高铁酸盐,电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O;铁丝网接触面积增大,加快反应速率,所以电流效率提高至70%以上,维持电流强度为5.0A,电解20min,通过电量为Q=It=5.0A×20×60s=6000C,F=96500C/mol,电子物质的量=$\frac{6000C}{96500C/mol}$=0.062mol,化学方程式计算可知电子转移6mol生成1molNa2FeO4,则电子转移0.062mol生成Na2FeO4物质的量也为$\frac{0.062mol}{6}$,质量=$\frac{0.062mol}{6}$×166g/mol≈1.7g,
理论上可生成Na2FeO4质量为1.7g,故答案为:Fe-6e-+8OH-=FeO42-+4H2O;铁丝网的接触面积更大;1.7g.
点评 本题考查较综合,涉及氧化还原反应、原电池原理等知识点,难度中等,做题时要正确理解这些概念的内涵,学会书写电极反应式.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案①取少量吸收液于试管中,加入过量的稀盐酸,产生淡黄色浑浊和气体,将所得的气体依次通入品红溶液、足量酸性KMnO4溶液和澄清石灰水,品红褪色,石灰水变浑浊
②另取少量待测液于试管中,加入过量的KClO3固体、AgNO3和稀硝酸,有白色沉淀产生
③另取少量待测液于试管中,酸化后再加入淀粉KI溶液,呈蓝色
④另取少量待测液于试管中,加入足量的BaCl2溶液和稀盐酸,有白色沉淀产生
下列说法正确的是( )
| A. | 由①可推测溶液中一定含大量CO32-、S2-、SO32-、NO3- | |
| B. | 由②可推测溶液中一定含大量NO2- | |
| C. | 由③可推测溶液中一定含大量NO3- | |
| D. | 由实验④难以推测溶液中一定含大量SO42- |
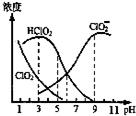
| A. | 使用该漂白剂的最佳pH为3 | |
| B. | pH=5时,溶液中$\frac{c(Cl{{O}_{2}}^{-})}{c(HCl{O}_{2})}$═$\frac{1}{10}$ | |
| C. | pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c( ClO2-)>c( ClO2)>c( Cl-) | |
| D. | NaClO2溶液加水稀释所有离子浓度均减小 |
| A. | 100 mL 0.8 mol•L-1MgCl2溶液 | B. | 50 mL 0.5 mol•L-1AlCl3溶液 | ||
| C. | 200 mL 1 mol•L-1NaCl溶液 | D. | 200 mL 2 mol•L-1KClO3溶液 |
| A. | 自来水中 | B. | 煤油中 | C. | 食盐水 | D. | 沙子中 |
| A. | 氯水中:2c(Cl2)═c(ClO-)+c(Cl-)+c(HClO) | |
| B. | 25℃时,pH=12的NaOH溶液与pH=12的氨水;c(Na+)═c(NH4+) | |
| C. | pH=4的0.1 mol•L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| D. | 在K2CO3溶液中:c(CO32-)+c(H+)═c(HCO3-) |
| A. | 0.lmol氯气与铁反应,转移0.2NA电子 | |
| B. | 0.lmol过氧化钠与水反应,转移0.2NA电子 | |
| C. | 0.lmol铁与高温水蒸汽反应,转移0.3NA电子 | |
| D. | 0.lmol二氧化锰与足量浓盐酸反应,有0.4NA Cl-被氧化 |

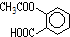 ,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.