题目内容
3.下列有关比较中,大小顺序排列不正确的是( )| A. | 热稳定性:HF>H2O>NH3>CH4 | |
| B. | 离子半径:S2->K+>Na+>Al3+ | |
| C. | 碱性:Mg(OH)2<KOH<CsOH | |
| D. | 给出质子的能力:H3PO4<H2SO4<HClO |
分析 A.非金属性越强,氢化物稳定性越强,同一周期中原子序数越大,非金属性越强;
B.离子的电子层越多,离子半径越大,电子层相同时,离子的核电荷数越大,离子半径越小;
C.金属性越强,最高价氧化物对应水合物的碱性越强;
D.酸性越强,给出质子的能力越强.
解答 解:A.同一周期中原子序数越大,非金属性越强,则非金属性:F>O>N>C,非金属性越强,对应氢化物的稳定性越强,则氢化物的热稳定性:HF>H2O>NH3>CH4,故A正确;
B.Na+、Al3+含有2个电子层,S2-、K+含有3个电子层,则Na+、Al3+的离子半径小于S2-、K+的,电子层相同时,核电荷数越大,离子半径越小,则离子半径大小为:S2->K+>Na+>Al3+,故B正确;
C.金属性Mg<K<Cs,则最高价氧化物对应水合物的碱性:Mg(OH)2<KOH<CsOH,故C正确;
D.酸性强弱为:HClO<H3PO4<H2SO4,酸性越强,给出质子的能力越强,则给出质子的能力强弱为:HClO<H3PO4<H2SO4,故D错误;
故选C.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,明确元素周期律内容为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
13.向5mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶度积关系为( )
| A. | AgCl=AgI=Ag2S | B. | AgCl<AgI<Ag2S | C. | AgI>AgCl>Ag2S | D. | AgCl>AgI>Ag2S |
14.下列实验现象与对应结论均正确的是( )
| 选项 | 操 作 | 现象 | 结论 |
| A | 将浓硫酸滴到胆矾晶体上 | 晶体逐渐变成白色 | 该过程发生物理变化 |
| B | 将过量过氧化钠固体投入紫色石蕊试液中 | 溶液变成蓝色 | 过氧化钠与水反应生成氢氧化钠,溶液呈碱性 |
| C | 向硝酸亚铁溶液中滴入稀硫酸 | 无明显现象 | 硝酸亚铁与硫酸不反应 |
| D | 将滴有酚酞的氨水加热 | 红色逐渐变浅 | 一水合氨受热分解,导致溶液碱性减弱 |
| A. | A | B. | B | C. | C | D. | D |
11.将铜片放入盛有稀硫酸烧杯中,没有明显的现象,当加入(或通入)下列物质后(可以加热),铜片溶解,溶液变蓝且不会产生有毒气体的是( )
| A. | CuO | B. | O2 | C. | NaNO3 | D. | HCl |
18. 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.
Ⅰ.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表.
则该温度下反应的平衡常数K=1.2.(精确到小数点后一位)
(2)相同条件下,向2L恒容密闭容器中充入1mol CO、1mol H2O(g)、2mol CO2、2mo1H2,此时v(正)<v(逆)(填“>”“=”或“<”).
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1.
(3)利用CO、H2合成液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1.
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响增加压强使反应速率加快,同时平衡右移,CH3OH产率增大.
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式C8H18-50e-+25O2-=8CO2+9H2O.
(6)已知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH80g.
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一.
(7)将CO2转化成有机物可有效地实现碳循环.如:
a.6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2 b.2CO2+6H2$→_{△}^{催化剂}$C2H5OH+3H2O
c.CO2+CH4$→_{△}^{催化剂}$CH3COOH d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
以上反应中,最节能的是a,反应b中理论上原子利用率为46%.
 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.Ⅰ.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表.
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
(2)相同条件下,向2L恒容密闭容器中充入1mol CO、1mol H2O(g)、2mol CO2、2mo1H2,此时v(正)<v(逆)(填“>”“=”或“<”).
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1.
(3)利用CO、H2合成液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1.
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响增加压强使反应速率加快,同时平衡右移,CH3OH产率增大.
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式C8H18-50e-+25O2-=8CO2+9H2O.
(6)已知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH80g.
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一.
(7)将CO2转化成有机物可有效地实现碳循环.如:
a.6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2 b.2CO2+6H2$→_{△}^{催化剂}$C2H5OH+3H2O
c.CO2+CH4$→_{△}^{催化剂}$CH3COOH d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
以上反应中,最节能的是a,反应b中理论上原子利用率为46%.
8.短周期主族元素W、X、Y、Z 的原子序数依次增大,W、X 原子的最外层电子数之比为4:3,Z 原子比X 原子的核外电子数多4.下列说法正确的是( )
| A. | W、Y、Z 的电负性大小顺序一定是Z>Y>W | |
| B. | Z 的氢化物分之间存在氢键 | |
| C. | Y、Z 形成的分子的中心原子可能采用sp3杂化 | |
| D. | WY2分子中σ键与π键的数目之比是2:1 |
15.肉桂酸在香精香料、食品添加剂、医药工业、美容、农药、有机合成等方面有着广泛应用.某同学查阅资料进行肉桂酸的合成并分析其纯度.合成原理和有关数据如下:
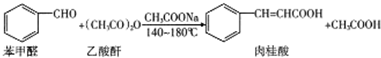
在三颈烧瓶中放入1.5mL(0.015mol)新蒸馏过的苯甲醛、4mL(0.036mol)新蒸馏过的乙酸酐以及研细的2.2g无水醋酸钠,加入2-3粒沸石,在石棉网上加热回流30min.
待反应物冷却后,加入10mL温水,改为水蒸气蒸馏蒸出未完全反应完的苯甲醛.再将烧瓶冷却,加入l0mL 10%氢氧化钠溶液.抽滤,将滤液倾入250mL烧杯中,冷却至室温,在揽拌下用浓盐酸酸化.冷却,抽滤,用少量冰水洗涤沉淀,抽干.粗产品在空气中晾干,产量约1.5g.
(1)某同学进行该实验时忘记加沸石,正确的操作为待反应物冷却后补加沸石.
(2)石棉网上冷凝回流时应使用球形冷凝管 仪器,回流的作用为提高反应物的转化率.
(3)加人过暈乙酸酐的目的是提高苯甲醛的转化率.
(4)加人10%NaOH溶液的作用是保证所有的肉桂酸转化为钠盐而溶解.
(5)冰水洗涤的作用是洗去肉桂酸中混有的NaCl杂质,同时降低肉桂酸的溶解度减少溶解损失,粗产品的进一步纯化可采用的方法是重结晶.
(6)肉桂酸的产率为67.6%.(保留三位有效数字)

| 名称 | 分子量 | 相对密度 | 熔点 | 沸点 | 溶解度 |
| 苯甲醛 | 106 | 1.04 | -26 | 179.62 | 微溶于水,可混溶于乙醇、乙醚、苯 |
| 乙酸酐 | 102 | 1.080 | -73.1 | 138.6 | 溶于乙醚,易水解形成乙酸. |
| 肉桂酸 | 148 | 1.247 | 135 | 300 | 微溶于水,可以溶于苯、丙酮、乙醚、乙醇等 |
待反应物冷却后,加入10mL温水,改为水蒸气蒸馏蒸出未完全反应完的苯甲醛.再将烧瓶冷却,加入l0mL 10%氢氧化钠溶液.抽滤,将滤液倾入250mL烧杯中,冷却至室温,在揽拌下用浓盐酸酸化.冷却,抽滤,用少量冰水洗涤沉淀,抽干.粗产品在空气中晾干,产量约1.5g.
(1)某同学进行该实验时忘记加沸石,正确的操作为待反应物冷却后补加沸石.
(2)石棉网上冷凝回流时应使用球形冷凝管 仪器,回流的作用为提高反应物的转化率.
(3)加人过暈乙酸酐的目的是提高苯甲醛的转化率.
(4)加人10%NaOH溶液的作用是保证所有的肉桂酸转化为钠盐而溶解.
(5)冰水洗涤的作用是洗去肉桂酸中混有的NaCl杂质,同时降低肉桂酸的溶解度减少溶解损失,粗产品的进一步纯化可采用的方法是重结晶.
(6)肉桂酸的产率为67.6%.(保留三位有效数字)
12.X、Y是第三周期的非金属元素,X原子半径比Y原子半径大,则下列叙述中正确的是( )
| A. | X的最高价氧化物对应水化物的酸性比Y的最高价氧化物对应水化物的酸性强 | |
| B. | X原子的得电子能力比Y原子的得电子能力强 | |
| C. | X的阴离子的还原性比Y的阴离子的还原性强 | |
| D. | X的气态氢化物比Y的气态氢化物稳定 |