题目内容
nmol H2O与mmolCaCO3中,氧元素的质量比是( )
| A、n:m | B、1:3 |
| C、n:3m | D、50n:27m |
考点:物质分子中的原子个数计算
专题:阿伏加德罗常数和阿伏加德罗定律
分析:根据分子中的原子构成关系结合m=nM来计算.
解答:
解:nmol H2O与mmolCaCO3中,氧原子的物质的量之比是n:3m,所以氧元素的质量比是n:3m,故选C.
点评:本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度不大,注意相关计算公式的运用.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
己烯雌酚是一种激素类药物,其结构简式如图所示.下列有关叙述中不正确的是( )
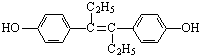

| A、己烯雌酚的分子式为C18H20O2 |
| B、己烯雌酚分子中一定有16个碳原子共平面 |
| C、己烯雌酚为芳香族化合物 |
| D、己烯雌酚可发生加成、取代、氧化、加聚、酯化、硝化反应 |
下列各组离子在指定条件下能大量共存的是( )
| A、无色溶液中:Cu2+、Na+、Cl-、NO3- |
| B、强酸性溶液中:Na+、K+、OH-、Cl- |
| C、含Fe3+的溶液中:K+、Ca2+、NO3-、OH- |
| D、澄清透明溶液中:Fe2+、Na+、SO42-、Cl- |
X、Y两个绝热容器中均盛有25ml2mol/l NaOH溶液,向X 中通入560ml(标准状况)CO2,向Y容器中加入1.1g干冰,对完全反应后的两容器中,下列说法正确的是( )
| A、两容器中c(Na+)不相等 |
| B、两容器内都有c(Na+)=2c(CO32-) |
| C、两容器内各种离子浓度均有c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c (H+) |
| D、两容器内离子浓度关系有c (H+)+c(Na+)=c(CO32-)+c(OH-)+c(HCO3-) |
关于硝酸的说法正确的是( )
| A、硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 |
| B、常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
| C、硝酸与金属反应时,主要是+5价的氮得电子 |
| D、浓HNO3与浓HCl按3:1的体积比所得的混合物叫王水 |
168O、188O、O2-、O2、O3是( )
| A、氧元素的五种不同微粒 |
| B、五种氧元素 |
| C、氧的五种同素异形体 |
| D、氧的五种同位素 |
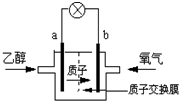 一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图.下面对这种电池的说法正确的是( )
一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图.下面对这种电池的说法正确的是( )| A、b极为电池的负极 |
| B、设每个电子所带电量为q库仑,则1mol乙醇被氧化产生12NAq库仑的电量 |
| C、电池工作时电流由a极沿导线经灯泡再到b极 |
| D、电池正极的电极反应为:O2+4e-+2H2O=4OH- |
下列有关说法不正确的是( )
| A、实验室制取氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| B、为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
| C、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ?mol-1则水电离的热化学方程式为:H2O(l)?H+(aq)+OH-(aq)△H=+57.3 kJ?mol-1 |
| D、生铁发生吸氧腐蚀和析氢腐蚀的负极反应均为:Fe-2e-=Fe2+ |