题目内容
10.常温下,甲为0.1mol/L的HA溶液,pH>1;乙为0.1mol/L的BOH溶液,且溶液中c(OH-):c(H+)=1012.请分别写出甲、乙两溶液中溶质的电离方程式HA?H++A-、BOH=B++OH-.分析 依据溶质浓度和溶液PH分析判断HA为弱酸,乙溶液中根据离子积常数和(OH-):c(H+)=1012 计算溶液中的氢氧根离子浓度分析判断BOH是强碱还是弱碱;依据强电解质、弱电解质写出电离方程式.
解答 解:甲为0.1mol/L的HA溶液,pH>1,说明酸未完全电离,即HA为弱酸,故其电离方程式为:HA?H++A-;乙溶液为0.1mol/L的BOH溶液,根据水的离子积可知溶液中c(H+)c(OH-)=10-14,而c(OH-):c(H+)=1012,可解得氢氧根离子浓度为:c(OH-)=10-13mol/L,即BOH是强碱,则电离方程式为:BOH=B++OH-;
故答案为:HA?H++A-;BOH=B++OH-.
点评 本题考查了弱电解质和强电解质的电离方程式的书写,应注意强电解质的电离用等号,弱电解质的电离用可逆号,题目难度中等.

练习册系列答案
相关题目
20.墨鱼骨粉(主要成分CaCO3)可作为治疗胃酸过多的药剂.CaCO3属于( )
| A. | 氧化物 | B. | 酸 | C. | 碱 | D. | 盐 |
1.二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良环保性能;二甲醚(CH3OCH3)是一种无色气体,具有轻微的醚香味,其燃烧热△H=一1455KJ/mol;以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.下列叙述正确是( )
| A. | 二甲醚分子中既含有极性键又含有非极性键 | |
| B. | 二甲醚与乙醛是同分异构体 | |
| C. | 在二甲醚构成的燃料电池中,每消耗0.5mol二甲醚可以向外电路提供6 mol e- | |
| D. | 二甲醚燃烧的热化学方程式表示为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-1455kJ/mol |
5.在常温下,取浓度相同的NaOH和HCl溶液,以3:2的体积比相混合(体积变化忽略不计),所得溶液的pH等于13,则原溶液的浓度为( )
| A. | 0.01mol•L-1 | B. | 0.05mol•L-1 | C. | 0.017mol•L-1 | D. | 0.50mol•L-1 |
15.25℃时,下列溶液中水的电离程度最大的是( )
| A. | 0.01mol/L盐酸 | B. | pH=11氨水 | ||
| C. | pH=4NaHSO3溶液 | D. | 0.01mol/L Na2CO3溶液 |
2.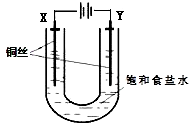 已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )
已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )
 已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )
已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )| A. | Y极发生的电极反应2H2O+2e-═2OH-+H2↑ | |
| B. | 实验开始时,X极附近出现白色浑浊 | |
| C. | 一段时间后,U形管底部形成橙黄色沉淀 | |
| D. | 电解时,Cl-移向Y极 |
20.下列有机物中,含有两种官能团的是( )
| A. | CH2=CHCH2Cl | B. | CH3OH | C. | Cl-C2H4-Cl | D. | Br-CH=CH-Cl |