题目内容
15.25℃时,下列溶液中水的电离程度最大的是( )| A. | 0.01mol/L盐酸 | B. | pH=11氨水 | ||
| C. | pH=4NaHSO3溶液 | D. | 0.01mol/L Na2CO3溶液 |
分析 酸和碱抑制水的电离,能水解的盐促进水的电离,依此进行判断.
解答 解:A、0.01 mol/L盐酸抑制水的电离,使水的电离程度减小;
B、PH=11氨水,抑制水的电离,使水的电离程度减小;
C、pH=4 的NaHSO3溶液电离大于水解,故抑制水的电离,使水的电离程度减小;
D、0.01 mol/L Na2CO3溶液能水解,故促进水的电离,使水的电离程度增大;
故水的电离程度最大的是0.01 mol/L Na2CO3溶液.
故选D.
点评 本题考查水的电离的影响因素,浓度不大.要注意酸和碱抑制水的电离,能水解的盐促进水的电离.

练习册系列答案
相关题目
5.用放射性同位素${\;}_{16}^{35}$S对杀虫剂进行标记,可跟踪杀虫剂的污染途径.该原子的中子数是( )
| A. | 16 | B. | 35 | C. | 19 | D. | 51 |
6.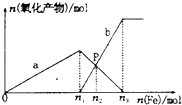 向含有1mol HNO3和1mol H2SO4的混合溶液中逐渐加人铁粉至过量溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断不正确的是( )
向含有1mol HNO3和1mol H2SO4的混合溶液中逐渐加人铁粉至过量溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断不正确的是( )
 向含有1mol HNO3和1mol H2SO4的混合溶液中逐渐加人铁粉至过量溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断不正确的是( )
向含有1mol HNO3和1mol H2SO4的混合溶液中逐渐加人铁粉至过量溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断不正确的是( )| A. | a表示Fe3+的关系曲线,b表示Fe3+的关系曲线 | |
| B. | P点时,n(Fe3+)=0.50 mol | |
| C. | n1=0.75 | |
| D. | n1:n3=2:3 |
3.1.5g 火箭燃料二甲基肼(CH3-NH-NH-CH3)完全燃烧放出50kJ热量,则二甲基肼的燃烧热为( )
| A. | 2000kJ | B. | △H=-2000kJ/mol | C. | △H=-1500kJ/mol | D. | -2000kJ/mol |
20.下列说法正确的是( )
| A. | 将金属A投入B的盐溶液,A溶解说明A的金属性比B的金属性强 | |
| B. | 氯碱工业和金属钠的冶炼都用到了NaC1,在电解时它们的阴极都是Na+得电子 | |
| C. | 向硫酸溶液中加入适量氨水,当溶液中c(SO42-)=c(NH4+)时,溶液呈酸性 | |
| D. | 等物质的量浓度的下列溶液中①NH4Cl ②NH4Al(SO4)2 ③NH3•H2O ④CH3COONH4,c(NH4+)由大到小的顺序是:①>②>③>④ |
7.下列化学用语和描述均正确的是( )
| A. | 空气中电子式为${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{C}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$的分子含量过多会造成温室效应 | |
| B. | 结构示意图为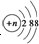 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| C. | 球棍模型为 的分子可发生加成反应 的分子可发生加成反应 | |
| D. | 电子式分别为Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-Na+和H${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H的两种化合物均为常见的氧化剂 |
4.下列离子方程式正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| B. | 过量铁粉溶于稀硝酸:Fe+NO3-+4H+═Fe3++2H2O+NO↑ | |
| C. | 氯气与水的反应:H2O+Cl2═2H++Cl-+ClO- | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,使沉淀物质的量最大:2Al3++3 Ba2++3SO42-+6OH-═2Al(OH)3↓+3BaSO4↓ |
3.在一密闭容器中,反应 a A(g)═b B(g)+c C(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,则下列判断不正确的是( )
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量分数增加了 | D. | a<b+c |