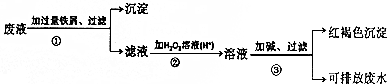
题目内容
18.现有甲、乙两瓶无色溶液,已知它们可能是AlCl3溶液和NaOH溶液.现做如下实验:①取440mL甲溶液与120mL乙溶液反应,产生1.56g沉淀;
②取120mL甲溶液与440mL乙溶液反应,也产生1.56g沉淀;
③取120mL甲溶液与400mL乙溶液反应,则产生3.12g沉淀;
通过必要的计算和推理判定:
(1)甲溶液为AlCl3溶液,其物质的量浓度是0.5mol/L;乙溶液为NaOH溶液,其物质的量浓度是0.5 mol/L.
(2)写出实验③的有关离子方程式:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
分析 (1)由②③可知,一定量的甲与乙反应时,乙的量越多,生成的沉淀越少,则乙为NaOH溶液,即甲为AlCl3溶液;根据①中发生AlCl3+3NaOH═Al(OH)3↓+3NaCl,碱不足来计算NaOH溶液的物质的量浓度;根据②中发生AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O,假设出最大沉淀量,并利用生成的沉淀的量来计算AlCl3溶液的浓度;
(2)铝离子先和氢氧根离子反应生成氢氧化铝沉淀,氢氧化铝沉淀再和过量的氢氧根离子反应生成偏铝酸根离子和水.
解答 解:(1)由②③可知,一定量的甲与乙反应时,乙的量越多,生成的沉淀越少,则乙为NaOH溶液,即甲为AlCl3溶液,
在①中发生AlCl3+3NaOH═Al(OH)3↓+3NaCl,1.56g沉淀的物质的量为$\frac{1.56g}{78g/mol}$=0.02mol,碱不足,完全反应,
则NaOH的物质的量为0.02mol×3=0.06mol,故NaOH溶液的物质的量浓度为$\frac{0.06mol}{0.12L}$=0.5mol/L,
在②中发生AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O,假设出沉淀最大量xmol,开始沉淀过程消耗氢氧根离子3xmol,
沉淀溶解过程氢氧化铝与氢氧化钠1:1反应,最后生成0.02mol氢氧化铝,所以消耗氢氧化钠(x-0.02)mol,
则一共消耗氢氧化钠为3x+(x-0.02)=0.44L×0.5mol/L=0.22mol,解得x=0.06mol,即最多有氢氧化铝0.06mol,所以原溶液含铝离子0.06mol,
氯化铝浓度为$\frac{0.06mol}{0.12L}$=0.5mol/L,
故答案为:AlCl3;0.5;NaOH;0.5;
(2)铝离子先和氢氧根离子反应生成氢氧化铝沉淀,氢氧化铝沉淀再和过量的氢氧根离子反应生成偏铝酸根离子和水,离子方程式分别为Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查化学方程式的有关计算,为高频考点,明确氢氧化铝性质是解本题关键,知道氧化铝和氢氧化钠溶液滴加顺序不同导致其产物不同,侧重考查学生分析计算能力,题目难度中等.

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案| A. | FeCl2(FeCl3) | B. | KCl(NaCl) | C. | Fe2O3(Al2O3) | D. | NaCl(MgCl2) |
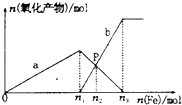 向含有1mol HNO3和1mol H2SO4的混合溶液中逐渐加人铁粉至过量溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断不正确的是( )
向含有1mol HNO3和1mol H2SO4的混合溶液中逐渐加人铁粉至过量溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断不正确的是( )| A. | a表示Fe3+的关系曲线,b表示Fe3+的关系曲线 | |
| B. | P点时,n(Fe3+)=0.50 mol | |
| C. | n1=0.75 | |
| D. | n1:n3=2:3 |
①向饱和碳酸钠溶液中通入过量的CO2; ②向NaAlO2溶液中逐滴加入过量的稀盐酸,
③向AlC13溶液中逐滴加入过量的稀氢氧化钠溶液; ④向Na2SiO3溶液中通入过量的CO2.
| A. | ①② | B. | ①④ | C. | ①③ | D. | ②③ |
| A. | 2000kJ | B. | △H=-2000kJ/mol | C. | △H=-1500kJ/mol | D. | -2000kJ/mol |
| A. | 空气中电子式为${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{C}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$的分子含量过多会造成温室效应 | |
| B. | 结构示意图为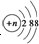 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| C. | 球棍模型为 的分子可发生加成反应 的分子可发生加成反应 | |
| D. | 电子式分别为Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-Na+和H${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H的两种化合物均为常见的氧化剂 |