题目内容
5.在常温下,取浓度相同的NaOH和HCl溶液,以3:2的体积比相混合(体积变化忽略不计),所得溶液的pH等于13,则原溶液的浓度为( )| A. | 0.01mol•L-1 | B. | 0.05mol•L-1 | C. | 0.017mol•L-1 | D. | 0.50mol•L-1 |
分析 物质的量浓度相等的NaOH和HCl溶液,以3:2体积比相混合,发生反应:NaOH+HCl=NaCl+H2O,氢氧化钠有剩余,令二者的浓度为cmol/L,用c表示出反应后溶液中c(OH-),根据混合后溶液的pH=13,可知应后溶液中c(OH-)=0.1mol/L,据此计算.
解答 解:物质的量浓度相等的NaOH和HCl溶液,以3:2体积比相混合,发生反应:NaOH+HCl=NaCl+H2O,氢氧化钠有剩余,令二者的浓度为cmol/L,则反应后溶液中c(OH-)=$\frac{3c-2c}{3+2}$mol/L=$\frac{c}{5}$mol/L,根据混合后溶液的pH=13,可知应后溶液中c(OH-)=0.1mol/L,即$\frac{c}{5}$mol/L=0.1mol/L,解得c=0.5,
故选D.
点评 本题考查溶液pH值的有关计算,难度不大,注意酸碱混合后呈碱性,先计算剩余氢氧根的浓度,再计算氢离子浓度,利用定义计算pH值.

练习册系列答案
相关题目
16.一定温度下,在密闭容器中进行可逆反应CO(g)+H2O(g)?CO2(g)+H2(g),下列说法正确的是( )
| A. | 该反应的化学平衡常数表达式为:K=$\frac{c(CO)•({H}_{2}O)}{c(C{O}_{2})•({H}_{2})}$ | |
| B. | 升高温度,正反应速率增大,逆反应速率减小 | |
| C. | 容器内CO和H20的浓度始终相等 | |
| D. | 容器内的压强始终不变 |
13.下列各项操作中,不会发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2; ②向NaAlO2溶液中逐滴加入过量的稀盐酸,
③向AlC13溶液中逐滴加入过量的稀氢氧化钠溶液; ④向Na2SiO3溶液中通入过量的CO2.
①向饱和碳酸钠溶液中通入过量的CO2; ②向NaAlO2溶液中逐滴加入过量的稀盐酸,
③向AlC13溶液中逐滴加入过量的稀氢氧化钠溶液; ④向Na2SiO3溶液中通入过量的CO2.
| A. | ①② | B. | ①④ | C. | ①③ | D. | ②③ |
20.关于如图所示转化关系(X代表卤素),说法不正确的是( )
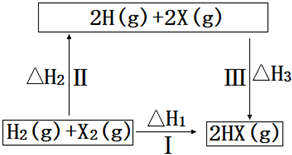

| A. | 2H(g)+2X(g)=2HX(g)△H3<0 | |
| B. | 途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3 | |
| C. | 途径Ⅰ生成HBr放出的热量比生成HCl的少,说明HBr比HCl稳定 | |
| D. | Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次减小 |
17.下列所述反应的方程式书写正确的是( )
| A. | 常温下,0.1 mol•L-1 HA溶液的pH=3,则HA的电离:HA=H++A- | |
| B. | 用铜电极电解饱和硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 向1 mL 2 mol•L-1NaOH溶液中滴加1~2滴0.1 mol•L-1MgCl2溶液后,再滴加2滴0.1 mol•L-1 FeCl3溶液:Mg2++2OH-═Mg(OH)2↓,3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| D. | 钢铁发生吸氧腐蚀生成铁锈:2Fe+O2+2H2O═2Fe(OH)2,4Fe(OH)2+O2+2H2O═4Fe(OH)3,2Fe(OH)3═Fe2O3•xH2O+(3-x)H2O |
14.常温下,下列说法错误的是( )
| A. | pH=6的NaHSO4溶液:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| B. | 0.1 mol/L NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积不变 | |
| C. | pH相同的①CH3COONa、②NaClO二种溶液的c(Na+):①<② | |
| D. | 0.1 mol/L Na2SO3溶液:c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3) |
15.二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,.
回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O
(2)滤渣B的主要成分是Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+,Zn2+杂质,可能原因是CuS、ZnS的溶解度较MnS小.
(4)碱性锌锰干电池在放电时,电池的总反应方程式可以表示为:Zn+2MnO2+2H2O═Zn(OH)2+2MnOOH,该电池的正极反应式为2MnO2+2H2O+2e-═2MnOOH+2OH-.

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,.
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 |
| 沉淀物 | CuS | ZnS | MnS | FeS | ||
| Ksp | 8.5×10-45 | 1.2×10-23 | 1.4×10-15 | 3.7×10-14 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O
(2)滤渣B的主要成分是Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+,Zn2+杂质,可能原因是CuS、ZnS的溶解度较MnS小.
(4)碱性锌锰干电池在放电时,电池的总反应方程式可以表示为:Zn+2MnO2+2H2O═Zn(OH)2+2MnOOH,该电池的正极反应式为2MnO2+2H2O+2e-═2MnOOH+2OH-.
