题目内容
20.下列有机物中,含有两种官能团的是( )| A. | CH2=CHCH2Cl | B. | CH3OH | C. | Cl-C2H4-Cl | D. | Br-CH=CH-Cl |
分析 决定有机物化学性质的原子或者原子团称为官能团,常见的官能团有:碳碳双键、碳碳三键、卤素原子、羟基、醛基、羧基、硝基等,然后结构有机物的结构简式进行判断.
解答 解:A.CH2=CH-CH2Cl分子中含的官能团为:碳碳双键和氯原子,含有两种官能团,满足条件,故A正确;
B.CH3OH分子中含有官能团为:-OH,只有1种官能团,故B错误;
C.Cl-C2H4-Cl中含有的官能团为-Cl,只含有1种官能团,故C错误;
D.Br-CH=CH-Cl中含有的官能团为:-Br、Cl-和碳碳双键,总共含有3种官能团,故D错误;
故选A.
点评 本题考查了有机物结构与官能团的判断,题目难度不大,明确官能团的概念及常见官能团类型为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
11.下列说法正确的是( )
| A. | SO2有漂白性,所以能使滴有酚酞的NaOH溶液褪色 | |
| B. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| C. | 能使品红溶液褪色的不一定是SO2 | |
| D. | SO2和Cl2都能漂白,若将两种气体同时通入,漂白效果会更好 |
15.二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,.
回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O
(2)滤渣B的主要成分是Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+,Zn2+杂质,可能原因是CuS、ZnS的溶解度较MnS小.
(4)碱性锌锰干电池在放电时,电池的总反应方程式可以表示为:Zn+2MnO2+2H2O═Zn(OH)2+2MnOOH,该电池的正极反应式为2MnO2+2H2O+2e-═2MnOOH+2OH-.

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,.
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 |
| 沉淀物 | CuS | ZnS | MnS | FeS | ||
| Ksp | 8.5×10-45 | 1.2×10-23 | 1.4×10-15 | 3.7×10-14 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O
(2)滤渣B的主要成分是Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+,Zn2+杂质,可能原因是CuS、ZnS的溶解度较MnS小.
(4)碱性锌锰干电池在放电时,电池的总反应方程式可以表示为:Zn+2MnO2+2H2O═Zn(OH)2+2MnOOH,该电池的正极反应式为2MnO2+2H2O+2e-═2MnOOH+2OH-.
3.在一密闭容器中,反应 a A(g)═b B(g)+c C(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,则下列判断不正确的是( )
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量分数增加了 | D. | a<b+c |
10.如图为铜锌原电池的示意图,下列有关的说法中不正确的是( )
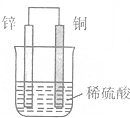

| A. | 锌片上有H2逸出 | B. | 溶液中c(H+)逐渐减小 | ||
| C. | 正极反应式:2H++2e-═H2↑ | D. | 负极反应式:Zn-2e-═Zn2+ |
7.如图是电解MgCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断不正确的是( )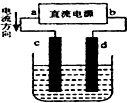

| A. | c、d电极上都有气体产生 | B. | d为阴极、c为阳极 | ||
| C. | d极附近溶液PH值升高 | D. | 电解过程中,氯离子浓度减小 |