题目内容
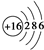
13.A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同.A与E形成的化合物的化学式为AE,其分子中含18个电子.请回答下列问题:(1)D元素的原子结构示意图为
 .
.(2)由A、B、C三种元素形成的化合物的电子式为
 ,这种化合物中所含的化学键类型有离子键、共价键.
,这种化合物中所含的化学键类型有离子键、共价键.(3)A2B的沸点高于A2D,其原因是H2O分子之间存在氢键.
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是ClO-+H2O?HClO+OH-(用离子方程式表示);将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),溶液的pH近似为7,则该过程的总化学反应方程式为2NaClO$\frac{\underline{\;光照\;}}{\;}$2NaCl+O2↑.
分析 A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同,则A为H元素;A与E形成的化合物的化学式为AE,其分子中含18个电子,则E为Cl元素;A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同,可知C为Na,B的最外层电子数为7-1=6,可知B为O,D为S,然后结合元素化合物来解答.
解答 解:A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同,则A为H元素;A与E形成的化合物的化学式为AE,其分子中含18个电子,则E为Cl元素;A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同,可知C为Na,B的最外层电子数为7-1=6,可知B为O,D为S,
(1)D元素为S,质子数为16,其原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)由A、B、C三种元素形成的化合物为NaOH,其电子式为 ,含离子键和共价键,
,含离子键和共价键,
故答案为: ;离子键、共价键;
;离子键、共价键;
(3)A2B的沸点高于A2D,其原因是H2O分子之间存在氢键,故答案为:H2O分子之间存在氢键;
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,该物质为NaClO,在25℃时,将该盐溶于水,测得溶液pH>7,发生水解显碱性,理由是ClO-+H2O?HClO+OH-,该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),溶液的pH近似为7,则该过程的总化学反应方程式为2NaClO$\frac{\underline{\;光照\;}}{\;}$2NaCl+O2↑,故答案为:ClO-+H2O?HClO+OH-;2NaClO$\frac{\underline{\;光照\;}}{\;}$2NaCl+O2↑.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、原子序数推断元素为解答的关键,侧重分析与应用能力的考查,注意化学键、氢键及水解原理的应用,题目难度不大.

( )
| A. | 1mol N2(g)和 3mol H2(g)具有的能量之和低于 2 mol NH3(g)具有的能量 | |
| B. | 将 1mol N2(g)和 3mol H2(g)置于一密闭容器中充分反应后放出 Q kJ 的热量 | |
| C. | 升高温度,平衡向逆反应方向移动,上述热化学方程式中的 Q 值减小 | |
| D. | 将一定量 N2、H2置于某密闭容器中充分反应放热 Q kJ,则此过程中有 3mol H2被氧化 |
| A. | 将溶质用蒸馏水溶解后,未冷却即转移至容量瓶中并定容 | |
| B. | 未洗涤溶解溶质用的烧杯及玻璃棒 | |
| C. | 定容时仰视刻度线观察液面 | |
| D. | 容量瓶中原来含有少量蒸馏水 |
| A. | 将4 g NaOH溶解在1L蒸馏水中 | |
| B. | 用托盘天平称量5.85g NaCl固体溶于蒸馏水,配成1000mL溶液 | |
| C. | 常温常压下,将11.2L HCl气体溶于蒸馏水,配成500mL溶液 | |
| D. | 取50 mL 0.5mol/L 的KNO3溶液用蒸馏水稀释,配成250mL 溶液 |
| A. | 41.3% | B. | 8.7% | C. | 1.74% | D. | 2.14% |
 在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题:
在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题: