题目内容
下列物质中:①氯化钠 ②干冰 ③盐酸 ④铜 ⑤硫酸钡 ⑥蔗糖 ⑦氨气 ⑧熔融的硝酸钾 ⑨食盐水
(1)能导电的是(填编号,下同) ;
(2)属于电解质的是 ;
(3)属于非电解质的是 .
(4)配平下列方程式:(计量数为1必须填入下面空格中)
K2Cr2O7+ HCl═ KCl+ CrCl3+ Cl2↑+ H2O.
(1)能导电的是(填编号,下同)
(2)属于电解质的是
(3)属于非电解质的是
(4)配平下列方程式:(计量数为1必须填入下面空格中)
考点:氧化还原反应方程式的配平,电解质与非电解质
专题:
分析:(1)物质导电有两种原因,一是金属类有自由移动的电子能够导电,二是能够产生自由离子的溶液能够导电,如酸碱盐的溶液;
(2)在水溶液里或熔融状态下能导电的化合物是电解质;
(3)在水溶液和熔化状态下都不能导电的化合物,属于非电解质;
(4)该反应中,Cr元素化合价由+6价变为+3价、Cl元素化合价由-1价变为0价,依据是得失电子数相等配平;
(2)在水溶液里或熔融状态下能导电的化合物是电解质;
(3)在水溶液和熔化状态下都不能导电的化合物,属于非电解质;
(4)该反应中,Cr元素化合价由+6价变为+3价、Cl元素化合价由-1价变为0价,依据是得失电子数相等配平;
解答:
解:(1)③盐酸中存在自由的氢离子和氯离子,所以能够导电;④铜有自由移动的电子能够导电,
⑧熔融的硝酸钾有自由移动的钾离子和硝酸根离子,所以能够导电;⑨食盐水中存在自由的钠离子和氯离子,所以能够导电,
故答案为:③④⑧⑨;
(2)①氯化钠、⑤硫酸钡为在水溶液中或在熔化状态下都能导电的化合物,则属于电解质;⑧熔融的硝酸钾为能导电的化合物,则属于电解质,
故答案为:①⑤⑧;
(3)②干冰为二氧化碳、⑦氨气、两者水溶液都能导电,但本身都不电离,则属于非电解质;⑥蔗糖为在水溶液中和在熔化状态下都不能导电的化合物,则属于非电解质,
故答案为:②⑥⑦;
(4)该反应中,一个HCl分子参加氧化还原反应失去1个电子,一个K2Cr2O7参加氧化还原反应得到6个电子,其最小公倍数是6,然后根据各元素的原子守恒进行配平,所以该反应方程式为1K2Cr2O7+14HCl=2KCl+2CrCl3+3C12+7H2O,
故答案为:1;14;2;2;3;7.
⑧熔融的硝酸钾有自由移动的钾离子和硝酸根离子,所以能够导电;⑨食盐水中存在自由的钠离子和氯离子,所以能够导电,
故答案为:③④⑧⑨;
(2)①氯化钠、⑤硫酸钡为在水溶液中或在熔化状态下都能导电的化合物,则属于电解质;⑧熔融的硝酸钾为能导电的化合物,则属于电解质,
故答案为:①⑤⑧;
(3)②干冰为二氧化碳、⑦氨气、两者水溶液都能导电,但本身都不电离,则属于非电解质;⑥蔗糖为在水溶液中和在熔化状态下都不能导电的化合物,则属于非电解质,
故答案为:②⑥⑦;
(4)该反应中,一个HCl分子参加氧化还原反应失去1个电子,一个K2Cr2O7参加氧化还原反应得到6个电子,其最小公倍数是6,然后根据各元素的原子守恒进行配平,所以该反应方程式为1K2Cr2O7+14HCl=2KCl+2CrCl3+3C12+7H2O,
故答案为:1;14;2;2;3;7.
点评:本题考查了物质的导电性、电解质、非电解质的判断,考查了氧化还原的配平,注意概念的辨析,注意依据是得失电子数相等配平,题目难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SO3、K2SiO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图所示:
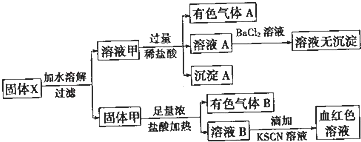
根据上述实验,以下说法正确的是( )

根据上述实验,以下说法正确的是( )
| A、溶液甲中一定含有K2SiO3、NaNO2 |
| B、无法判断溶液中是否有K2SO3 |
| C、气体A和气体B-定为混合物 |
| D、原混合物中一定有Fe2O3 |
某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):下列说法正确的是( )


| A、固体混合物中一定含有Al,但质量不可确定 |
| B、固体混合物中一定不含有AlCl3 |
| C、固体混合物中一定含有MgCl2和FeCl2 |
| D、固体混合物中一定含有 (NH4)2SO4和MgCl2,且物质的量之比为1:1 |
向下列溶液中滴加稀H2SO4,生成白色沉淀,继续滴加稀H2SO4,沉淀又溶解的是( )
| A、MgCl2溶液 |
| B、Na2SiO3溶液 |
| C、Cu(NO3)2溶液 |
| D、Na[Al(OH)4]溶液 |
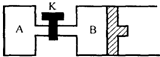 如图所示,B中活塞可以自由滑动.A、B中均有1mol X、1mol Y,起始时,V(A)=V(B)=a L.关闭K,相同温度下,两容器中同时发生反应:2X(g)+2Y(g)=Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时,V(B)=0.8a L.
如图所示,B中活塞可以自由滑动.A、B中均有1mol X、1mol Y,起始时,V(A)=V(B)=a L.关闭K,相同温度下,两容器中同时发生反应:2X(g)+2Y(g)=Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时,V(B)=0.8a L.