题目内容
17. 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
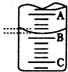
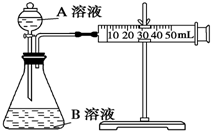
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL.
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.实验结束时俯视滴定管中液面,读取滴定终点时NaOH溶液的体积
B.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式:C=$\frac{c×(25.35+25.30)}{2V}$.
分析 (1)精确量取酸性溶液应该用酸式滴定管;根据酸碱反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂;通过观察溶液颜色变化判断终点,酚酞在酸性溶液中为无色,达到终点溶液稍显碱性,溶液变成浅红色;
(2)A与C刻度间相差1ml,说明每两个小格之间是0.1mL,A处的刻度为25,据此确定B的刻度,注意滴定管的上面数值小,下面数值大;
(3)根据所用过程判断不当操作对相关物理量的影响;
(4)根据化学方程式CH3COOH+NaOH═CH3COONa+H2O计算醋酸的浓度.
解答 解:(1)向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管量取;醋酸与氢氧化钠反应生成了醋酸钠,醋酸钠属于强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂,故选酚酞;滴定时锥形瓶中为酸性溶液,酚酞在酸性溶液中为无色,达到终点溶液稍显碱性,变浅红色,则锥形瓶由无色变为浅红色且半分钟内不复原,说明达到滴定终点;
故答案为:酸式滴定管;酚酞;锥形瓶由无色变为浅红色且半分钟内不复原;
(2)A与C刻度间相差1ml,说明每两个小格之间是0.10mL,A处的刻度为25,A和B之间是四个小格,所以相差0.40mL,则B是25.40mL,
故答案为:25.40;
(3)A.实验结束时俯视滴定管中液面,读取滴定终点时NaOH溶液的体积,液面偏高,读数偏小,导致NaOH溶液体积偏小,故A错误;
B.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定,反应不充分,导致NaOH溶液体积偏小,故B错误;
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗,标准液被稀释,浓度偏小,导致NaOH溶液体积偏大,故C正确;
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,醋酸的物质的量偏大,导致NaOH溶液体积偏大,故D正确;
故选:CD;
(4)第一次数据相差较大,舍去,其余两次使用氢氧化钠溶液的平均体积=$\frac{25.32+25.30}{2}$mL,
CH3COOH+NaOH═CH3COONa+H2O
1 1
c(CH3COOH)×VmL cmo1/L×$\frac{25.32+25.30}{2}$mL
解得:c(CH3COOH)=$\frac{c×(25.35+25.30)}{2V}$mol/L;
故答案为:$\frac{c×(25.35+25.30)}{2V}$.
点评 本题主要考查了中和滴定操作、误差分析以及计算,难度不大,理解中和滴定的原理是解题关键.

| A. | 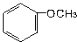 | B. | 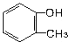 | C. | 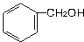 | D. | CH3-O-CH3 |
| A. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH}{→}$Na2SiO3(aq) | |
| B. | CuO$→_{△}^{H_{2}}$Cu$\stackrel{稀硫酸}{→}$CuSO4(aq) | |
| C. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO4 | |
| D. | NaCl饱和溶液$→_{②CO_{2}}^{①NH_{3}}$NaHCO3$\stackrel{△}{→}$Na2CO3 |
实验用品:仪器(略,凡是实验需要的均有提供)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三支相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况.结果如下:
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 | |
| 实验1 | 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 实验2 | 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 实验3 | 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
(1)写出铝与盐酸反应的离子方程式是2Al+6H+═2Al3++3H2↑
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是反应放出热量,温度升高,使化学反应速率加快.
(3)将实验2中硫酸的浓度设计为1.5mol/L的依据是统一氢离子的浓度,比较阴离子在反应中的不同作用
(4)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一:促进金属铝表面的氧化膜与H+反应
假设二:对金属铝表面的氧化膜与H+反应起阻碍作用.
 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.(1)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:
| 序号 | A | B |
| 1 | 2ml0.1mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液 |
| 2 | 2ml0.2mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液 |
| 3 | 2ml0.2mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液和少量MnSO4溶液 |
(2)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小.
取两支试管各加入2mL 0.1mol/L H2C2O4溶液,另取两支试管各加入4mL 0.1mol/L KMnO4溶液.将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对化学反应速率的影响,但该组同学始终没有看到溶液明显褪色,其原因是KMnO4溶液过量.
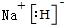 ;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.
;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.
 (或
(或 、
、 ).
).