题目内容
18.给定条件下,下列选项中所示的物质间转化均能一步实现的是( )| A. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH}{→}$Na2SiO3(aq) | |
| B. | CuO$→_{△}^{H_{2}}$Cu$\stackrel{稀硫酸}{→}$CuSO4(aq) | |
| C. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO4 | |
| D. | NaCl饱和溶液$→_{②CO_{2}}^{①NH_{3}}$NaHCO3$\stackrel{△}{→}$Na2CO3 |
分析 A、二氧化硅不溶于水;
B、铜与稀硫酸不反应;
C、亚硫酸是弱酸,弱酸不能制强酸;
D、饱和食盐水中通入氨气、二氧化碳会发生生成碳酸氢钠晶体,碳酸氢钠加热分解生成碳酸钠;
解答 解:A、二氧化硅不溶于水,也不与水反应所以不能由二氧化硅一步转化为硅酸,故A错误;
B、铜与稀硫酸不反应,所以不能由铜与稀硫酸反应,故B错误;
C、亚硫酸是弱酸,弱酸不能制强酸,则二氧化硫与氯化钡不反应,故C错误;
D、饱和食盐水中通入氨气、二氧化碳会发生生成碳酸氢钠晶体,碳酸氢钠加热分解生成碳酸钠,饱和NaCl溶液$\stackrel{N{H}_{3}、C{O}_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3,可以实现各步的一步转化,故D正确;
故选D.
点评 本题考查了物质性质的分析应用,主要是反应产物和反应条件的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气生成的速率.
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4.
(3)要加快上述实验中气体产生的速率,还可采取的措施有增加锌的表面积;升高温度或适当增大硫酸的浓度等(答两种).
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体.记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因:当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(1)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气生成的速率.
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4.
(3)要加快上述实验中气体产生的速率,还可采取的措施有增加锌的表面积;升高温度或适当增大硫酸的浓度等(答两种).
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体.记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因:当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
9.下列分子中中心原子采取sp2杂化的是( )
| A. | PCl3 | B. | CH4 | C. | BF3 | D. | H2O |
13.下列醇经催化氧化的产物是 的是( )
的是( )
 的是( )
的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
3.下列叙述错误的是( )
| A. | 用AgNO3溶液可以鉴别KCl和KI | |
| B. | SO2使溴水褪色与乙烯使KMnO4溶液褪色原理相同 | |
| C. | 可根据硫酸密度的大小判断铅蓄电池是否需要充电 | |
| D. | 制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 |
10.下列图象中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是( )
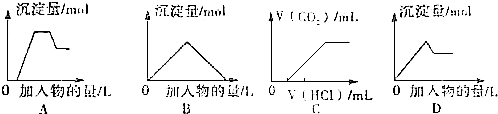

| A. | 图A表示想含OH-、AlO2-、CO32-、SiO32-、的溶液中滴加HCL溶液产生沉淀量的关系曲线 | |
| B. | 图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线 | |
| C. | 图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线 | |
| D. | 图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线 |
17. 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
(1)向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管,该实验应选用酚酞作指示剂,达到滴定终点的实验现象是:锥形瓶由无色变为浅红色且半分钟内不复原.
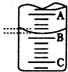
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL.
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是CD
A.实验结束时俯视滴定管中液面,读取滴定终点时NaOH溶液的体积
B.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式:C=$\frac{c×(25.35+25.30)}{2V}$.
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL.
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.实验结束时俯视滴定管中液面,读取滴定终点时NaOH溶液的体积
B.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式:C=$\frac{c×(25.35+25.30)}{2V}$.
 有机物之间的反应通常比较复杂,同样的反应物在不同条件下生成不同的产物.
有机物之间的反应通常比较复杂,同样的反应物在不同条件下生成不同的产物. 某铵态氮肥由W、X、Y、Z等四种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z等四种短周期元素组成,其中W的原子半径最小. ;X和Y的原子半径N>O(填元素符号)
;X和Y的原子半径N>O(填元素符号)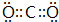 .
.