题目内容
9.下列不能说明Cl的得电子能力比S强的亊实是( )①HCl比H2S稳定
②HCl0氧化性比KH2S04强
③HClO4酸性比H2SO4强
④Cl2能与H2S 反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成 FeCl3,S与Fe反应生成FeS.
| A. | ②⑤ | B. | ①② | C. | ①②④ | D. | ①③⑤ |
分析 ①元素的非金属性越强,对应的氢化物越稳定;
②最高价含氧酸;
③最高价含氧酸,酸性越强元素的非金属性越强,得电子能力越强;
④Cl2能与H2S反应生成S,说明氯气的氧化性比S强,单质的氧化性越强,对应的元素的非金属性越强;
⑤非金属性的强弱与原子最外层电子数多少无关;
⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS,说明Cl原子得电子能力强.
解答 解:①元素的非金属性越强,对应的氢化物越稳定,而HCl比H2S稳定,所以氯的非金属性强于硫,则Cl的得电子能力比S强,故正确;
②最高价含氧酸,次氯酸不是最高价含氧酸,故错误;
③最高价含氧酸,酸性越强元素的非金属性越强,得电子能力越强,HClO4酸性比H2SO4强,所以氯的非金属性强于硫,则Cl的得电子能力比S强,故正确;
④Cl2能与H2S反应生成S,说明氯气的氧化性比S强,单质的氧化性越强,对应的元素的非金属性越强,则Cl的得电子能力比S强,故正确;
⑤非金属性的强弱与原子最外层电子数多少无关,故错误;
⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS,说明Cl原子得电子能力强,故正确;
故选A.
点评 本题考查非金属性的比较,题目难度不大,注意把握比较的角度,注意最高价氧化物的酸性,对应元素非金属性.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.下列分子中中心原子采取sp2杂化的是( )
| A. | PCl3 | B. | CH4 | C. | BF3 | D. | H2O |
10.下列图象中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是( )
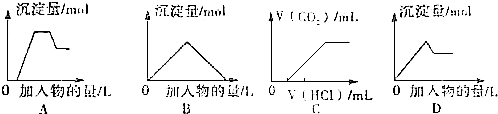

| A. | 图A表示想含OH-、AlO2-、CO32-、SiO32-、的溶液中滴加HCL溶液产生沉淀量的关系曲线 | |
| B. | 图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线 | |
| C. | 图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线 | |
| D. | 图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线 |
17. 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
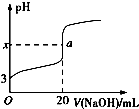
(1)向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管,该实验应选用酚酞作指示剂,达到滴定终点的实验现象是:锥形瓶由无色变为浅红色且半分钟内不复原.
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL.
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是CD
A.实验结束时俯视滴定管中液面,读取滴定终点时NaOH溶液的体积
B.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式:C=$\frac{c×(25.35+25.30)}{2V}$.
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL.
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.实验结束时俯视滴定管中液面,读取滴定终点时NaOH溶液的体积
B.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式:C=$\frac{c×(25.35+25.30)}{2V}$.
4.草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
现用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
(1)该反应中还原剂是H2C2O4.(填化学式)
(2)对比实验I和II(用Ⅰ~Ⅳ表示,下同),可以研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,对比实验I和III.
(3)对比实验Ⅰ和Ⅳ,可以研究硫酸的浓度(或氢离子的浓度)对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保对比实验中c(KMnO4)、c(H2C2O4)相同(溶液总体积相同).
现用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
(2)对比实验I和II(用Ⅰ~Ⅳ表示,下同),可以研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,对比实验I和III.
(3)对比实验Ⅰ和Ⅳ,可以研究硫酸的浓度(或氢离子的浓度)对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保对比实验中c(KMnO4)、c(H2C2O4)相同(溶液总体积相同).
1.下列反应能设计成原电池的是( )
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 石灰石分解反应 | ||
| C. | NaOH溶液与盐酸反应 | D. | 甲烷与O2的反应 |
19.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: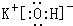 .
.
(3)最高价氧化物是两性氧化物的元素是Al;
(4)用电子式表示元素④与⑥的化合物的形成过程: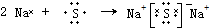 .
.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
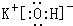 .
.(3)最高价氧化物是两性氧化物的元素是Al;
(4)用电子式表示元素④与⑥的化合物的形成过程:
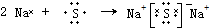 .
. 
 某铵态氮肥由W、X、Y、Z等四种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z等四种短周期元素组成,其中W的原子半径最小. ;X和Y的原子半径N>O(填元素符号)
;X和Y的原子半径N>O(填元素符号)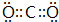 .
.