题目内容
10.浓度均为cmol•L-1的硫酸和NaOH溶液等体积混合后所得溶液中,Na2SO4的物质的量浓度为0.25mol/L,c(Na+)=0.5mol/L.分析 发生反应为:H2SO4+2NaOH=Na2SO4+H2O,根据n=cV可知两溶液中硫酸和氢氧化钠的物质的量相等,则混合液中氢氧化钠不足,根据钠离子守恒计算出硫酸钠、钠离子的物质的量浓度.
解答 解:设两溶液体积均为VL,浓度均为cmol•L-1的硫酸和NaOH溶液等体积混合后所得溶液中,根据n=cV可知两溶液中硫酸和氢氧化钠的物质的量相等,根据反应H2SO4+2NaOH=Na2SO4+H2O可知,NaOH不足,钠离子完全转化成硫酸钠,根据质量守恒反应后溶液中满足:n(Na+)=n(NaOH)=2n(Na2SO4)=cVmol,
则反应后溶液中:c(Na+)=$\frac{cVmol}{2VL}$=0.5cmol/L,c(Na2SO4)=$\frac{1}{2}$c(Na+)=0.5cmol/L×$\frac{1}{2}$=0.25mol/L,
故答案为:0.25mol/L;0.5mol/L.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确发生反应实质为解答关键,注意掌握物质的量浓度的概念及表达式,试题有利于提高学生的化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列钢铁腐蚀属于原电池原理的是( )
| A. | 吸氧腐蚀 | B. | 与稀盐酸反应 | ||
| C. | 与氧气反应 | D. | 高温下与水蒸气反应 |
1.有关Na、Mg两种元素的性质叙述正确的是( )
| A. | 金属性:Na<Mg | |
| B. | 原子半径:Na>Mg | |
| C. | 单质的还原性:Na<Mg | |
| D. | 最高价氧化物对应水化物的碱性:NaOH<Mg(OH)2 |
18.下列关于物质性质与应用的说法正确的是( )
| A. | 二氧化碳有氧化性,在点燃条件下能将金属镁氧化 | |
| B. | 二氧化硫有漂白、杀菌性能,可在食品加工中大量使用 | |
| C. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| D. | 二氧化锰具有较强的氧化性,可作H2O2分解的氧化剂 |
5.某小组用如图装置进行实验,下列说法正确的是( )
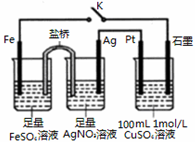

| A. | 盐桥中的电解质可以用KC1 | |
| B. | 闭合K,石墨电极上只生成铜 | |
| C. | 当有0.1mol Fe溶解时,流经电解液的电子个数为1.204×1023 | |
| D. | 导线中流过0.3mol电子时,加入11.1gCu2(OH)2CO3,CuSO4溶液可恢复原组成 |
15.下列关于胶体的叙述正确的是( )
| A. | 胶体不稳定,静置后容易产生沉淀 | |
| B. | 可用丁达尔效应区别溶液与悬浊液 | |
| C. | 溶液中溶质粒子不能通过半透膜,胶体中分散质粒子能透过半透膜 | |
| D. | 胶体与其他分散系的本质区别是分散质粒子直径在1 nm~100nm之间 |
19.下列用品的有效成分及用途对应错误的是( )
| A. | 用品: 有效成分:NaCl用途:做调味品 有效成分:NaCl用途:做调味品 | |
| B. | 用品: 有效成分:Na2CO3用途:做发酵粉 有效成分:Na2CO3用途:做发酵粉 | |
| C. | 用品: 有效成分:Al(OH)3用途:做抗酸药 有效成分:Al(OH)3用途:做抗酸药 | |
| D. | 用品: 有效成分:Ca(ClO)2用途:做消毒剂 有效成分:Ca(ClO)2用途:做消毒剂 |
20.已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2.下列有关离子反应或离子方程式的叙述中,正确的是( )
| A. | 向0.1molFeI2溶液中滴加少量氯水,反应中有0.3mol电子转移 | |
| B. | 向溴水中加入足量氯化亚铁能使溶液变成无色 | |
| C. | 向NaClO溶液中通入少量CO2的离子方程式:ClO-+CO2+H2O═HClO+HCO3- | |
| D. | 能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存 |
 在烧杯里加入20mL 0.1mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液.实验装置如图(夹持仪器已去掉):
在烧杯里加入20mL 0.1mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液.实验装置如图(夹持仪器已去掉):