题目内容
5.某小组用如图装置进行实验,下列说法正确的是( )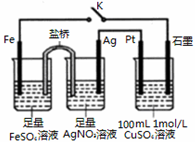
| A. | 盐桥中的电解质可以用KC1 | |
| B. | 闭合K,石墨电极上只生成铜 | |
| C. | 当有0.1mol Fe溶解时,流经电解液的电子个数为1.204×1023 | |
| D. | 导线中流过0.3mol电子时,加入11.1gCu2(OH)2CO3,CuSO4溶液可恢复原组成 |
分析 闭合K时,根据装置可以判断含有盐桥的为原电池装置,其中铁比银活泼为负极,银为正极,硫酸铜为电解装置,与铁相连的石墨为阴极,与银相连的为阳极,据此分析解答.
解答 解:A.由于KCl能和AgNO3产生沉淀,因此盐桥中的电解质不能用KCl,故A错误;
B.闭合K,与铁相连的石墨为阴极,发生还原反应首先Cu2++2e-═Cu,析出Cu,后发生2H++2e-═H2,放出氢气,故B错误;
C.0.1mol铁失去0.2mol电子,但电子不能通过溶液传递,而是经过导线,故C错误;
D.CuSO4溶液中n(Cu2+)=0.1mol,完全消耗时转移电子数为0.2mol,导线中流过03mol e-说明水也参与了电解,电解CuSO4的总反应2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,溶液中减少的是2Cu和O2(相当于2CuO),需要补充0.1molCuO,电解水的总反应2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,转移电子数为0.1mol,因此消耗0.05mol的H2O,Cu2(OH)2CO3可写为2CuO•H2O•CO2,所以加入0.05mol×222g/mol=11.1g Cu2(OH)2CO3,CuSO4溶液可恢复原组成,故D正确;
故选D.
点评 本题考查原电池、电解池的工作原理,题目难度不大,注意电极的判断和电极方程式的书写,把握原电池、电解池的工作原理,学习中注意相关知识的把握.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
17.下列描述的一定是金属元索的是( )
| A. | 原子核内有4个质子的元素 | B. | 能与水反应的单质 | ||
| C. | 原子的最外层只有2个电子的元素 | D. | 能形成离子化合物的元素 |
16.将W1g光亮的铜丝在空气中加热一段时间后,迅速插入下列物质中,取出干燥,如此反复几次,最后取出铜丝用蒸馏水洗涤、干燥,称得其质量为W2 g.实验时由于所插入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系正确的是( )
| A. | 石灰水,W1=W2 | B. | 乙醇溶液,W1=W2 | C. | NaHSO4,W1<W2 | D. | CO,W1>W2 |
13.下列关于气体制备不正确的是( )
| A. | 铜与稀硝酸反应制取NO2 | |
| B. | 碳酸钙与稀盐酸反应制取二氧化碳 | |
| C. | 双氧水在MnO2催化下反应制取氧气 | |
| D. | 氯化铵固体与氢氧化钙固体混合加热制取氨气 |
20.某烃的衍生物A,其分子式为C6H12O2,实验表明A和NaOH溶液共热生成B和C,B和盐酸反应生成有机物D,C在铜催化作用和加热条件下氧化为E,其中D能发生银镜反应而E不能.由此判断A的可能结构有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
15.将Cl2和H2置于0.5L密闭容器中,反应20s后,生成2.0molHCl.在这段时间内,用HCl浓度变化表示的平均反应速率为( )
| A. | 20mol•(L•min)-1 | B. | 0.1mol•(L•s)-1 | C. | 0.2mol•(L•s)-1 | D. | 0.4mol•(L•min)-1 |

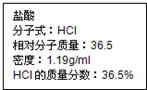 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: