题目内容
2. 在烧杯里加入20mL 0.1mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液.实验装置如图(夹持仪器已去掉):
在烧杯里加入20mL 0.1mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液.实验装置如图(夹持仪器已去掉):实验现象如下:
①灯泡逐渐变暗;
②烧杯中有白色沉淀生成,溶液红色变浅甚至消失.
请依据实验现象回答下列问题:
(1)灯泡变暗的原因是溶液中可自由移动离子的浓度变小.
(2)有白色沉淀生成,说明Ba2+与SO42-发生了反应,红色变浅说明发生了H+与OH-发生了反应,使溶液碱性减弱.
(3)当Ba2+恰好完全沉淀时,消耗NaHSO4溶液的体积为20 mL,离子反应方程式为Ba2++OH-+SO42-+H+═BaSO4↓+H2O.
(4)若向(3)得到的溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为H++OH-═H2O.
分析 Ba(OH)2与NaHSO4发生反应:①Ba2+沉淀完全:Ba2++OH-+SO42-+H+═BaSO4↓+H2O;②溶液呈中性:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O;反应过程中,溶液中离子的浓度减小,其导电能力减弱,灯泡变暗,以此来解答.
解答 解:(1)反应生成硫酸钡,使溶液中可自由移动离子的浓度变小,导电性减弱,则灯泡变暗,
故答案为:溶液中可自由移动离子的浓度变小;
(2)白色沉淀为硫酸钡,是Ba2+与SO42-发生了反应,红色变浅,氢氧根离子浓度减小,发生了H+与OH-发生了反应,使溶液碱性减弱,
故答案为:Ba2+与SO42-发生了反应;发生了H+与OH-发生了反应,使溶液碱性减弱;
(3)当Ba2+恰好完全沉淀时,发生Ba2++OH-+SO42-+H+═BaSO4↓+H2O,以1:1反应,浓度相等,则体积相同,即NaHSO4溶液的体积为20mL,碱性减弱,颜色变浅,
故答案为:20;Ba2++OH-+SO42-+H+═BaSO4↓+H2O;
(4)向(3)得到的溶液中,继续滴加NaHSO4溶液到恰好变为无色,只发生H+与OH-的反应,离子反应为H++OH-═H2O,
故答案为:H++OH-═H2O.
点评 本题考查离子反应方程式的书写,为高考常见题型,明确发生的化学反应为解答的关键,把握反应的先后顺序及现象与导电性的关系,题目难度中等.

练习册系列答案
相关题目
12.将0.1mol/L的醋酸钠溶液20ml与0.1mol/L盐酸10mL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是( )
| A. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)>c(OH-) | |
| C. | c(CH3 COO-)=c(Cl-)>c(H+)>c(CH3COOH)>c(OH-) | |
| D. | c(Cl-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
13.下列关于气体制备不正确的是( )
| A. | 铜与稀硝酸反应制取NO2 | |
| B. | 碳酸钙与稀盐酸反应制取二氧化碳 | |
| C. | 双氧水在MnO2催化下反应制取氧气 | |
| D. | 氯化铵固体与氢氧化钙固体混合加热制取氨气 |
7.下列选用的仪器和药品不能达到实验目的是( )
| A | B | C | D |
 |  |  |  |
| 分离NH4Cl和Ca(OH)2固体 | X为四氯化碳,可用于吸收氨气,并防止倒吸 | 验证浓硫酸的脱水性和强氧化性 | 验证HCl气体在水中的溶解性 |
| A. | A | B. | B | C. | C | D. | D |
11.在某无色、透明的强酸性溶液中,能大量共存的离子组是( )
| A. | NH4+、NO3-、Al3+、Cl- | B. | K+、SO42-、Ba2+、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | H+、SO42-、HCO3-、Na+ |
12.物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是( )
| A. | Na2CO3、NaHCO3、NaCl、NH4Cl | B. | Na2CO3、NaHCO3、NH4Cl、NaCl | ||
| C. | NH4Cl、(NH4)2SO4、Na2S、NaNO3 | D. | (NH4)2SO4、NH4Cl、NaNO3、Na2S |

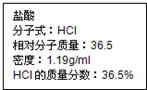 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: