题目内容
有A、B、C、D、E五种化合物,它们分别由Na+、Ba2+、Cu2+、A13+、Cl-、SO42-和OH-等七种离子中的两种组成.(反应中用的是溶液)
①白色固体A既不溶于水,也不溶于稀硝酸.
②把B逐滴加入C中开始产生白色沉淀,后来沉淀消失.
③把D逐滴加入C中至过量始终有白色沉淀.
④D可与E反应产生蓝色沉淀,滴加足量稀硝酸沉淀全部溶解.
根据上述实验事实,回答下列问题:
(1)写出下列物质的化学式:
A B C D E
(2)写出②中反应的离子方程式:
(3)写出足量的D与C反应的离子方程式:
(4)④中反应的离子方程式(两个): . .
①白色固体A既不溶于水,也不溶于稀硝酸.
②把B逐滴加入C中开始产生白色沉淀,后来沉淀消失.
③把D逐滴加入C中至过量始终有白色沉淀.
④D可与E反应产生蓝色沉淀,滴加足量稀硝酸沉淀全部溶解.
根据上述实验事实,回答下列问题:
(1)写出下列物质的化学式:
A
(2)写出②中反应的离子方程式:
(3)写出足量的D与C反应的离子方程式:
(4)④中反应的离子方程式(两个):
考点:物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:(1)①白色固体A既不溶于水,也不溶于稀硝酸应为硫酸钡;
②把B逐滴加入C中开始产生白色沉淀,后来沉淀消失,铝离子与氢氧根离子反应,先生成氢氧化铝,再生成偏铝酸盐,可知B中含有铝离子,C中含有氢氧根离子;
③把D逐滴加入C中至过量始终有白色沉淀,说明C中含有能够形成沉淀的阳离子钡离子,又因为C中含有氢氧根离子所以C为氢氧化钡,D中含有硫酸根离子;
④D可与E反应产生蓝色沉淀,滴加足量稀硝酸沉淀全部溶解,可知该蓝色沉淀为氢氧化铜,D中含有铜离子,E中含有氢氧根离子,E为可溶性碱,只能为氢氧化钠;
(2)氯化铝加入氢氧化钡,先反应生成氢氧化铝和氯化钡;氢氧化铝再与氢氧化钡反应生成偏铝酸钡;
(3)硫酸铜与氢氧化钡反应生成硫酸钡、氢氧化铜沉淀;
(4)氢氧化钠与硫酸铜反应生成氢氧化铜沉淀;氢氧化铜与硝酸反应生成硝酸铜和水.
②把B逐滴加入C中开始产生白色沉淀,后来沉淀消失,铝离子与氢氧根离子反应,先生成氢氧化铝,再生成偏铝酸盐,可知B中含有铝离子,C中含有氢氧根离子;
③把D逐滴加入C中至过量始终有白色沉淀,说明C中含有能够形成沉淀的阳离子钡离子,又因为C中含有氢氧根离子所以C为氢氧化钡,D中含有硫酸根离子;
④D可与E反应产生蓝色沉淀,滴加足量稀硝酸沉淀全部溶解,可知该蓝色沉淀为氢氧化铜,D中含有铜离子,E中含有氢氧根离子,E为可溶性碱,只能为氢氧化钠;
(2)氯化铝加入氢氧化钡,先反应生成氢氧化铝和氯化钡;氢氧化铝再与氢氧化钡反应生成偏铝酸钡;
(3)硫酸铜与氢氧化钡反应生成硫酸钡、氢氧化铜沉淀;
(4)氢氧化钠与硫酸铜反应生成氢氧化铜沉淀;氢氧化铜与硝酸反应生成硝酸铜和水.
解答:
解:(1)①白色固体A既不溶于水,也不溶于稀硝酸应为硫酸钡,故A为硫酸钡;
②把B逐滴加入C中开始产生白色沉淀,后来沉淀消失,铝离子与氢氧根离子反应,先生成氢氧化铝,再生成偏铝酸盐,可知B中含有铝离子,C中含有氢氧根离子;
③把D逐滴加入C中至过量始终有白色沉淀,说明C中含有能够形成沉淀的阳离子钡离子,又因为C中含有氢氧根离子,所以C为氢氧化钡,D中含有硫酸根离子;
④D可与E反应产生蓝色沉淀,滴加足量稀硝酸沉淀全部溶解,可知该蓝色沉淀为氢氧化铜,D中含有铜离子,又因为D中含有硫酸根离子,所以D为硫酸铜,E中含有氢氧根离子,为氢氧化钠;
故答案为:BaSO4;AlCl3;Ba(OH)2;CuSO4;NaOH;
(2)氯化铝加入氢氧化钡,先反应生成氢氧化铝和氯化钡,离子方程式:Al3++3OH-=Al(OH)3↓;
氢氧化铝再与氢氧化钡反应生成偏铝酸钡,离子方程式为:Al(OH)3+OH-=AlO2-+H2O;
故答案为:Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+H2O;
(3)硫酸铜与氢氧化钡反应生成硫酸钡、氢氧化铜沉淀,离子方程式:Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓;
故答案为:Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓;
(4)氢氧化钠与硫酸铜反应生成氢氧化铜沉淀,离子方程式为:Cu2++2OH-=Cu(OH)2↓;
氢氧化铜与硝酸反应生成硝酸铜和水,离子方程式为:Cu(OH)2+2H+=Cu2++2H2O;
故答案为:Cu2++2OH-=Cu(OH)2↓;Cu(OH)2+2H+=Cu2++2H2O.
②把B逐滴加入C中开始产生白色沉淀,后来沉淀消失,铝离子与氢氧根离子反应,先生成氢氧化铝,再生成偏铝酸盐,可知B中含有铝离子,C中含有氢氧根离子;
③把D逐滴加入C中至过量始终有白色沉淀,说明C中含有能够形成沉淀的阳离子钡离子,又因为C中含有氢氧根离子,所以C为氢氧化钡,D中含有硫酸根离子;
④D可与E反应产生蓝色沉淀,滴加足量稀硝酸沉淀全部溶解,可知该蓝色沉淀为氢氧化铜,D中含有铜离子,又因为D中含有硫酸根离子,所以D为硫酸铜,E中含有氢氧根离子,为氢氧化钠;
故答案为:BaSO4;AlCl3;Ba(OH)2;CuSO4;NaOH;
(2)氯化铝加入氢氧化钡,先反应生成氢氧化铝和氯化钡,离子方程式:Al3++3OH-=Al(OH)3↓;
氢氧化铝再与氢氧化钡反应生成偏铝酸钡,离子方程式为:Al(OH)3+OH-=AlO2-+H2O;
故答案为:Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+H2O;
(3)硫酸铜与氢氧化钡反应生成硫酸钡、氢氧化铜沉淀,离子方程式:Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓;
故答案为:Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓;
(4)氢氧化钠与硫酸铜反应生成氢氧化铜沉淀,离子方程式为:Cu2++2OH-=Cu(OH)2↓;
氢氧化铜与硝酸反应生成硝酸铜和水,离子方程式为:Cu(OH)2+2H+=Cu2++2H2O;
故答案为:Cu2++2OH-=Cu(OH)2↓;Cu(OH)2+2H+=Cu2++2H2O.
点评:本题考查了离子的鉴别和离子方程式的书写,明确离子的性质和发生反应的实质是解题关键,题目难度中等.

练习册系列答案
相关题目
HPE是合成除草剂的重要中间体,其结构简式如图所示.有关HPE的说法正确的是( )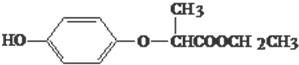

| A、HPE不能跟浓溴水反应 |
| B、1molHPE最多可以和2mol NaOH反应 |
| C、HPE在核磁共振氢谱中有6个峰 |
| D、HPE分子中有2个手性碳原子 |
X、Y、Z分别是三种非金属单质,M、N、R是三种常见的氧化物,只有一种氧化物具有高熔点,而且有如下反应(条件未标出,方程未配平):(1)X+Z→N;(2)M+X→N;(3)R+X→Y+N.下列说法正确的是( )
| A、Y是地壳中含量最多的元素 |
| B、非金属性:X>Y |
| C、X、Y同主族,Y、Z同周期 |
| D、高熔点的氧化物是M |
 短周期元素X、Y、Z、W原子序数依次增大.X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中.请回答:
短周期元素X、Y、Z、W原子序数依次增大.X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中.请回答: