题目内容
欧盟定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
C+ KMnO4+ H2SO4→ CO2↑+ MnSO4+ K2SO4+ H2O
(2)焦炭可用于制取水煤气.测得12g 碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式: .
(3)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如表:
①写出NO与活性炭反应的化学方程式 .
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1= .
Ⅱ.根据上述信息判断,温度T1和T2的关系是 (填序号).
a.T1>T2 b.T1<T2 c.无法比较
(4)CO2经常用氢氧化钠溶液来吸收,现有0.4molCO2,若用200mL 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: .
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO 为负极燃气,空气与 CO2 的混合气为正极助燃气,制得在 650℃下工作的燃料电池,其负极反应式:2CO-4e-+2CO32-=4CO2,则正极反应式: .
(6)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为 .
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
(2)焦炭可用于制取水煤气.测得12g 碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式:
(3)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如表:
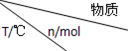 | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=
Ⅱ.根据上述信息判断,温度T1和T2的关系是
a.T1>T2 b.T1<T2 c.无法比较
(4)CO2经常用氢氧化钠溶液来吸收,现有0.4molCO2,若用200mL 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO 为负极燃气,空气与 CO2 的混合气为正极助燃气,制得在 650℃下工作的燃料电池,其负极反应式:2CO-4e-+2CO32-=4CO2,则正极反应式:
(6)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为
考点:化学平衡的计算,氧化还原反应方程式的配平,热化学方程式,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)反应中C元素的化合价由0升高为+4价,Mn元素的化合价由+7价降低为+2价,结合化合价升降总数相等以及质量守恒定律配平;
(2)12g碳的物质的量为1mol,与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,据此结合热化学方程式书写原则进行书写;
(3)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2;
②Ⅰ、计算各气体的平衡浓度,代入平衡常数表达式计算;
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,不能判断温度变化;
(4)据二氧化碳和氢氧化钠之间反应量的关系:按照1:2反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠来计算回答,根据溶液中离子浓度大小比较的方法结合电离和水解平衡来分析;
(5)通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO32-;
(6)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
(2)12g碳的物质的量为1mol,与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,据此结合热化学方程式书写原则进行书写;
(3)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2;
②Ⅰ、计算各气体的平衡浓度,代入平衡常数表达式计算;
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,不能判断温度变化;
(4)据二氧化碳和氢氧化钠之间反应量的关系:按照1:2反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠来计算回答,根据溶液中离子浓度大小比较的方法结合电离和水解平衡来分析;
(5)通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO32-;
(6)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
解答:
解:(1)反应中C元素的化合价由0升高为+4价,Mn元素的化合价由+7价降低为+2价,该反应中转移20e-,由电子守恒和质量守恒定律可知得化学反应为5C+4KMnO4+6HSO4=5CO2↑+4MnSO4+2K2SO4+6H2O,
故答案为:5;4;6;5;4;2;6;
(2)12g碳的物质的量为1mol,与水蒸气反应生成CO、H2,吸收131.6kJ热量,该反应的热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6 kJ?mol-1,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6 kJ?mol-1.
(3)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,故反应方程式为:C+2NO?N2+CO2,
故答案为:C+2NO?N2+CO2;
②Ⅰ、平衡时c(NO)=
=0.02mol/L,c(N2)=c(CO2)=
=0.015mol/L,故T1℃时该反应的平衡常数为K1=
=
,故答案为:
;
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为:c;
(4)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:2反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,0.4molCO2和200mL 3mol/L NaOH溶液混合,二者的物质的量之比是2:3,所的溶液是碳酸钠和碳酸氢钠的混合物,在混合物中,碳酸根离子水解程度大与碳酸氢根离子的水解程度,所以c(CO32-)<c(HCO3-),即c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(5)正极上的电极反应式为O2+4e-+2CO2=2CO32-,故答案为:O2+4e-+2CO2=2CO32-;
(6)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=
×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)?c(Ca2+)=3.8×10-9可知,c(Ca2+)=
mol/L=3.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×3.8×10-5mol/L=7.6×10-5mol/L.
故答案为:7.6×10-5mol/L.
故答案为:5;4;6;5;4;2;6;
(2)12g碳的物质的量为1mol,与水蒸气反应生成CO、H2,吸收131.6kJ热量,该反应的热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6 kJ?mol-1,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6 kJ?mol-1.
(3)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,故反应方程式为:C+2NO?N2+CO2,
故答案为:C+2NO?N2+CO2;
②Ⅰ、平衡时c(NO)=
| 0.04mol |
| 2L |
| 0.03mol |
| 2L |
| 0.015×0.015 |
| 0.02 2 |
| 9 |
| 16 |
| 9 |
| 16 |
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为:c;
(4)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:2反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,0.4molCO2和200mL 3mol/L NaOH溶液混合,二者的物质的量之比是2:3,所的溶液是碳酸钠和碳酸氢钠的混合物,在混合物中,碳酸根离子水解程度大与碳酸氢根离子的水解程度,所以c(CO32-)<c(HCO3-),即c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(5)正极上的电极反应式为O2+4e-+2CO2=2CO32-,故答案为:O2+4e-+2CO2=2CO32-;
(6)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=
| 1 |
| 2 |
| 3.8×10 - 9 |
| 1×10 - 4 |
故答案为:7.6×10-5mol/L.
点评:本题考查平衡常数、化学平衡的有关计算、热化学方程式的书写、氧化还原方程式的书写、离子浓度大小比较、溶度积的有关计算等方面的知识,注重高频考点的考查,综合性强,题目难度大.

练习册系列答案
相关题目
在一个体积不变的密闭容器中,盛有等物质的量的SO2、O2、SO3(气)的混合气体,在一定温度和压强下,反应达平衡时,容器中混合气体的密度比反应前减少了
(温度、压强反应前后不变),则反应达平衡时,混和气体中SO2占总体积的( )
| 1 |
| 13 |
A、
| ||
B、
| ||
C、
| ||
D、
|
在1200℃时,天然气脱硫工艺中会发生下列反应 H2S(g)+
O2(g)=SO2(g)+H2O(g)△H1 2H2S(g)+SO2(g)=
S2(g)+2H2O(g)△H2 H2S(g)+
O2(g)=S(g)+H2O(g)△H3 2S(g)=S2(g)△H4则△H4的正确表达式为( )
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
A、△H4=
| ||
B、△H4=
| ||
C、△H4=
| ||
D、△H4=
|