题目内容
在一个体积不变的密闭容器中,盛有等物质的量的SO2、O2、SO3(气)的混合气体,在一定温度和压强下,反应达平衡时,容器中混合气体的密度比反应前减少了
(温度、压强反应前后不变),则反应达平衡时,混和气体中SO2占总体积的( )
| 1 |
| 13 |
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:化学平衡的计算
专题:化学平衡专题
分析:在相同温度、相同压强下,气体的物质的量之比等于体积之比,根据密度变化(即体积变化)计算反应后气体的物质的量,再根据气体的物质的量之比等于体积之比,可计算出混和气体中SO2的体积分数.
解答:
解:等物质的量的SO2、O2、SO3(气)的混合气体,在一定温度和压强下,反应达平衡时,容器中混合气体的密度比反应前减少了
,则根据ρ=mV体积增大了
,根据在相同温度、相同压强下,气体的物质的量之比等于体积之比,故反应向逆方向进行,
设等物质的量的SO2、O2、SO3(气)各xmol,向逆反应方向转化的SO3(气)ymol
2SO2(g)+O2(g)?2SO3(g),
起始量(mol) x x x
变化量(mol) y 0.5y y
平衡量(mol) x+y x+0.5y x-y
根据容器中混合气体的密度比反应前减少了
,则根据ρ=mV体积增大了
,故有
=
,解得 x=2y;
所以反应达平衡时,混和气体中SO2占总体积的分数为
=
=
;
故选D.
| 1 |
| 13 |
| 1 |
| 12 |
设等物质的量的SO2、O2、SO3(气)各xmol,向逆反应方向转化的SO3(气)ymol
2SO2(g)+O2(g)?2SO3(g),
起始量(mol) x x x
变化量(mol) y 0.5y y
平衡量(mol) x+y x+0.5y x-y
根据容器中混合气体的密度比反应前减少了
| 1 |
| 13 |
| 1 |
| 12 |
| x+y+x+0.5y+x-y |
| 3x |
| 13 |
| 12 |
所以反应达平衡时,混和气体中SO2占总体积的分数为
| x+y |
| 3x+0.5y |
| 3 |
| 6.5 |
| 6 |
| 13 |
故选D.
点评:本题考查化学平衡的计算,题目难度中等,本题侧重于体积分数的计算,解答本题的关键根据容器中混合气体的密度比反应前减少了
,则根据ρ=mV体积增大了
,根据在相同温度、相同压强下,气体的物质的量之比等于体积之比,故反应向逆方向进行来计算.
| 1 |
| 13 |
| 1 |
| 12 |

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
向浑浊的水中加入适量的明矾[KAl(SO4)2?12H2O]并搅拌以后,水便由浑浊变得澄清.在此过程中发生的主要变化( )
| A、是纯化学变化 |
| B、是纯物理变化 |
| C、既是物理变化又是化学变化 |
| D、不能确定是化学变化还是物理变化 |
对于反应2SO2(g)+O2(g)?2SO3(g),能增大正反应速率且提高O2的转化率的措施是( )
| A、移去部分SO3 |
| B、降低体系温度 |
| C、通入大量O2 |
| D、通入大量SO2 |
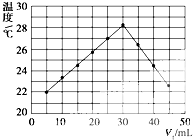 将V1 mL 1.00mol?L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1 mL 1.00mol?L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A、做该实验时环境温度为22℃ |
| B、该实验表明所有化学反应化学能只转化为热能 |
| C、NaOH溶液的浓度为1.50 mol?L-1 |
| D、该实验表明有水生成的反应都是放热反应 |
下列叙述正确的是( )
| A、由于Ksp(BaSO4)=1.1×10-10小于Ksp(BaCO3)=5.1×10-9,则不能使BaSO4沉淀转化为BaCO3沉淀 |
| B、在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的最高温度作为末温度 |
| C、除去CH3COOC2H5中的CH3COOH先加足量的饱和Na2CO3溶液再蒸馏 |
| D、能使湿润的KI淀粉试纸变蓝的气体一定是Cl2 |
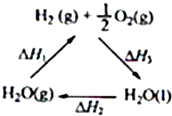 某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:mCeO2
| 太阳能 |
| ① |
(m-x)CeO2?xCe+xH2O+xCO2
| 900℃ |
| ② |
下列说法不正确的是( )
| A、该过程中CeO2没有消耗 | ||
| B、该过程实现了太阳能向化学能的转化 | ||
| C、图中△H1=△H2+△H3 | ||
D、H2(g)+
|