题目内容
在1200℃时,天然气脱硫工艺中会发生下列反应 H2S(g)+
O2(g)=SO2(g)+H2O(g)△H1 2H2S(g)+SO2(g)=
S2(g)+2H2O(g)△H2 H2S(g)+
O2(g)=S(g)+H2O(g)△H3 2S(g)=S2(g)△H4则△H4的正确表达式为( )
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
A、△H4=
| ||
B、△H4=
| ||
C、△H4=
| ||
D、△H4=
|
考点:用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:利用盖斯定律分析,不管化学反应是一步或分几步完成,其反应热是不变的;根据目标方程改写分方程,然后求出反应热.
解答:
解:根据目标方程,把方程3反写,计量数乘以2;把方程2乘以
;把方程1乘以
;然后三者相加;即△H4=-△H3×2+△H2×
+△H1×
=
(△H1+△H2-3△H3),
故选B.
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
故选B.
点评:本题考查了盖斯定律的应用,要注意方程式计量数的变化,及△H的符号的变化.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
NA代表阿伏加德罗常数.下列说法中,正确的是( )
| A、标准状况下,2.24LSO3中含有氧原子数目为0.3NA |
| B、0.1 molCl2全部溶于水后转移电子数目为0.1 NA |
| C、只有在标准状况下,NA个 O2所占的体积才是22.4L |
| D、6.0g甲酸甲酯和正丙醇的混合物中含甲基数目为0.1 NA |
合成氨工业中的H2是通过反应CO+H2O?CO2+H2制得的.现在一定温度下,将1molCO和3mol水蒸气置于密闭容器中反应,达平衡后测得CO2为0.75mol,再通入6mol水蒸气,重新达到平衡后,CO2和H2的物质的量之和为( )
| A、1.2 mol |
| B、1.5 mol |
| C、1.8 mol |
| D、2.5 mol |
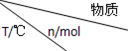

 +
+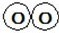
 +
+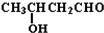
 +CO
+CO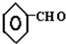

 (1)已知:
(1)已知: