题目内容
8.碳酸有两个电离常数Ki1、Ki2,分别对应碳酸的两步电离.关于Ki1和Ki2说法正确的是( )| A. | Ki1的表达式为Ki1=$\frac{[{H}_{2}C{O}_{3}]}{[{H}^{+}][HC{{O}_{3}}^{-}]}$ | |
| B. | Ki2对应的电离过程是HCO3-+H2O?H3O++CO32- | |
| C. | 当碳酸的电离平衡正向移动时,Ki1与Ki2均相应增大 | |
| D. | 改变条件使Ki1减小,则Ki2一定也减小 |
分析 A、Ki1的表达式为Ki1=$\frac{c({H}^{+})c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$;
B、Ki2对应的电离过程是HCO3-+H2O?CO32-+H3O+;
C、Ki1与Ki2是温度的函数;
D、电离过程是吸热过程,要使Ki1减小,只能是降温,所以Ki2一定减小;
解答 解:A、Ki1的表达式为Ki1=$\frac{c({H}^{+})c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$,故A错误;
B、Ki2对应的电离过程是HCO3-+H2O?CO32-+H3O+,故B正确;
C、Ki1与Ki2是温度的函数,与反应进行的方向无关,故C错误;
D、电离过程是吸热过程,要使Ki1减小,只能是降温,所以Ki2一定减小,故D正确;
故选BD.
点评 本题考查了弱电解质的电离,学生要清楚电离子常数表达式的书写、影响因素是解本题关键,难度中等.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 非金属氧化物都是酸性氧化物 | |
| B. | 凡是酸性氧化物都可以直接与水反应生成对应的酸 | |
| C. | 氧化物都能与酸或碱反应生成盐 | |
| D. | 碱性氧化物都是金属氧化物 |
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | c(H+)=10-12 mol/L的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、HCO3-、Cl- | |
| C. | 1.0 mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| D. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- |
16.下列有关炼铁和炼钢的说法中,错误的是( )
| A. | 炼铁目的是将生铁进行还原 | B. | 炼铁时加入石灰石除脉石 | ||
| C. | 炼钢目的是将生铁进行氧化 | D. | 炼钢时加入生石灰造渣 |
13.下列化学用语表达错误的是( )
| A. | NH3的电子式: | B. | Al2O3+3H2 $\stackrel{高温}{→}$ 2Al+3H2O | ||
| C. | 氯离子的结构示意图: | D. | N原子的轨道表示式: |
20.一定量饱和Na2CO3溶液中逐滴加入稀盐酸直至过量,开始阶段无现象,后来冒气泡.以下判断错误的是( )
| A. | CO32-离子是弱酸根,开始阶段与H+结合,生成HCO3- | |
| B. | 溶液中的Na+、Cl-抑制了CO2生成 | |
| C. | 开始生成的CO2与Na2CO3反应,生成了NaHCO3 | |
| D. | CO32-离子在水中,存在两个水解平衡,开始阶段可能是H+结合OH-,生成HCO3- |
17.2011年诺贝尔化学奖授予发现准晶体的以色列化学家.准晶体原子排列有序,但准晶体不具备晶体的对称性.下列归类肯定错误的是( )
| A. | 碘单质-分子晶体 | B. | 铝铜铁合金-准晶体 | ||
| C. | 石墨-原子晶体 | D. | 氧化镁-离子晶体 |
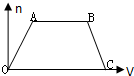 将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如图所示,图中AB段表示的离子方程式先后顺序正确的是( )
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如图所示,图中AB段表示的离子方程式先后顺序正确的是( )