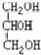题目内容
17.2011年诺贝尔化学奖授予发现准晶体的以色列化学家.准晶体原子排列有序,但准晶体不具备晶体的对称性.下列归类肯定错误的是( )| A. | 碘单质-分子晶体 | B. | 铝铜铁合金-准晶体 | ||
| C. | 石墨-原子晶体 | D. | 氧化镁-离子晶体 |
分析 A.大多数非金属单质是分子晶体;
B.准晶体不具备晶体的对称性;
C.石墨属于混合晶体;
D.阴阳离子间通过离子键形成的晶体是离子晶体.
解答 解:A.大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)是分子晶体,则碘单质是分子晶体,故A正确;
B.铝铜铁合金不具备晶体的对称性,属于准晶体,故B正确;
C.石墨是层状结构,在层与层之间以范德华力相互作用,有分子晶体的特点,在层内碳与碳以共价键相互作用,有原子晶体的特点,石墨属于混合晶体,故C错误;
D.氧化镁是离子化合物,属于阴阳离子间通过离子键形成的离子晶体,故D正确;
故选C.
点评 本题考查晶体的结构和分类,明确晶体和准晶体的不同点是解本题关键,石墨不是原子晶体为易错点,难度中等.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
8.碳酸有两个电离常数Ki1、Ki2,分别对应碳酸的两步电离.关于Ki1和Ki2说法正确的是( )
| A. | Ki1的表达式为Ki1=$\frac{[{H}_{2}C{O}_{3}]}{[{H}^{+}][HC{{O}_{3}}^{-}]}$ | |
| B. | Ki2对应的电离过程是HCO3-+H2O?H3O++CO32- | |
| C. | 当碳酸的电离平衡正向移动时,Ki1与Ki2均相应增大 | |
| D. | 改变条件使Ki1减小,则Ki2一定也减小 |
5.下列实验目的可以达到的是( )
| A. | 将滴有稀硫酸的淀粉溶液加热后,加入新制的Cu(OH)2悬浊液,加热,没有红色沉淀,说明淀粉在该条件下没有水解 | |
| B. | 将铜与足量的浓硝酸反应生成的气体干燥后收集,用冰水混合物冷却降温,研究温度对化学平衡的影响 | |
| C. | 将混合气体通过饱和Na2CO3溶液以便除去CO2中少量的SO2 | |
| D. | 某无色溶液中加入Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO42- |
2.下列有机物的结构简式和名称都正确的是( )
| A. | 2-甲基丁醛 CH3CH2 (CH3)CHCOH | B. | 硬酯酸甘油脂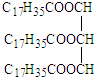 | ||
| C. | TNT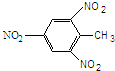 | D. | α-氨基丙酸 CH3CH(NH2)COOH |
9.五种短周期元素在元素周期表中的位置如图所示,其中X元素最高正化合价与最低负化合价的代数和为0,下列判断正确的是( )
| X | |||||
| Z | Y | M | N |
| A. | 原子半径:Y>X | |
| B. | 阴离子还原性:N>M | |
| C. | 最高价氧化物对应水化物的碱性:Y>Z | |
| D. | 气态氢化物稳定性:M>N |
6.聚乙炔能够导电,下列关于聚乙炔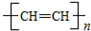 和聚合物A
和聚合物A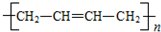 的说法中正确的是( )
的说法中正确的是( )
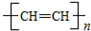 和聚合物A
和聚合物A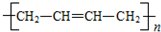 的说法中正确的是( )
的说法中正确的是( )| A. | 两种聚合物的单体互为同系物 | |
| B. | 聚合物A不属于单双键交错的结构. | |
| C. | 聚合物A的相对分子质量是聚乙炔的两倍 | |
| D. | 两种聚合物的单体各1 mol,分别与Br2发生加成反应时最多消耗Br2的物质的量之比为2:1 |

 和
和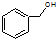
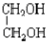 与
与