题目内容
17.有反应:3C+SiO2$\frac{\underline{\;高温\;}}{\;}$SiC+2CO,下列说法正确的是( )| A. | SiC是氧化产物 | |
| B. | 还原剂与氧化剂的物质的量之比为1:2 | |
| C. | 若生成4.48LCO,则转移0.4 mol 电子 | |
| D. | C 既是氧化剂又是还原剂 |
分析 反应3C+SiO2$\frac{\underline{\;高温\;}}{\;}$SiC+2CO中,Si元素化合价没有发生变化,C元素化合价分别由0价升高为+2价和降低为-4价,则C既是氧化剂又是还原剂;氧化产物为CO,SiC为还原产物,以此解答该题.
解答 解:A.生成SiC,C元素化合价降低,则SiC为还原产物,故A错误;
B.C既是氧化剂又是还原剂,由方程式可知3molC参加反应,有2mol被氧化,1mol被还原,则在反应中氧化剂和还原剂的物质的量之比为1:2,故B错误;
C.CO存在的条件未知,不能确定物质的量,故C错误;
D.C元素化合价分别由0价升高为+2价和降低为-4价,则C既是氧化剂又是还原剂,故D正确.
故选D.
点评 本题考查了氧化还原反应的计算,题目难度中等,明确氧化还原反应的实质、特征为解答关键,注意掌握氧化剂与还原剂、氧化产物与还原产物的概念及判断方法,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列实验操作能达到实验目的是( )
| A. | 向容量瓶中注入液体时,奖容量瓶的玻璃塞倒置在桌面上防止被污染 | |
| B. | 鉴别NO2和溴蒸汽时,将二者分别通到湿润的KI-淀粉试纸上观察颜色变化 | |
| C. | 将甲烷和乙烯的混合气体通入足量溴水,以除去乙烯 | |
| D. | 将洗净的滴定管放到烘箱中烘干,以加快干燥速度 |
5. 最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
 最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )| A. | 放电时,负极发生:2AlCl4--e-=Al2Cl3-+Cl- | |
| B. | 充电时,泡沫石墨极与外电源的负极相连 | |
| C. | 放电时,电路中每流过3mol电子,正极减少27g | |
| D. | 充电时,阴极发生:4Al2Cl3-+3e-=Al+7AlCl4- |
2.化学药品的毒性可以通过皮肤吸收、消化道吸收和呼吸道吸收三种方式对人体健康产生危害,下列预防措施错误的是( )
| A. | 实验过程中使用四氯化碳时戴防尘口罩 | |
| B. | 实验过程中移取强酸、强碱溶液应带防酸碱手套 | |
| C. | 实验场所严禁携带食物;禁止用饮料瓶装化学药品,防止误食 | |
| D. | 称取粉末状的有毒药品时,要带口罩防止吸入 |
9.在元素周期表的主族元素中,甲元素与乙、丙、丁三种元素上下紧密相邻或左右紧密相邻,丙元素的原子序数等于甲、乙两种元素的原子序数之和,四种元素原子的最外层电子数之和为20.下列说法正确的是( )
| A. | 甲、乙、丙、丁四种元素均为短周期元素 | |
| B. | 元素丁形成的化合物比元素乙形成的化合物少 | |
| C. | 气态氢化物的稳定性比较:甲>乙 | |
| D. | 最高价氧化物对应水化物的酸性比较:甲<丙 |
6.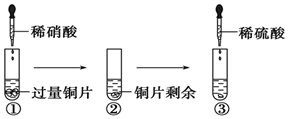 某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是
某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是
( )
 某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是
某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是( )
| A. | ①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2 | |
| B. | ③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O | |
| C. | ③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强 | |
| D. | 由上述实验可知:Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应 |
7.下列有关说法正确的是( )
| A. | 加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 | |
| B. | 向某溶液中滴加硝酸酸化的BaCl2溶液产生白色沉淀,则该溶液中含有SO42- | |
| C. | 在电解精炼铜过程中,阳极质量的减少多于阴极质量的增加 | |
| D. | 298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其△H<0 |
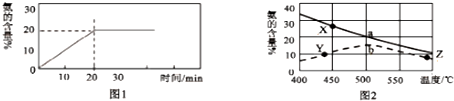
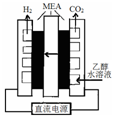 氢能是一种极具发展潜力的清洁能源.硫碘循环分解水是最具潜力的制氢方法.其反应原理如下:
氢能是一种极具发展潜力的清洁能源.硫碘循环分解水是最具潜力的制氢方法.其反应原理如下: