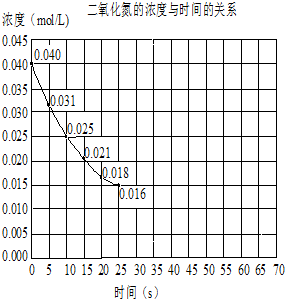
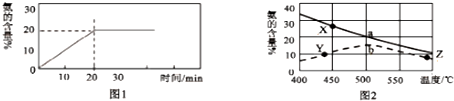
题目内容
6.用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 1L 1mol/L的盐酸中含HCl分子的数目为NA | |
| B. | 1 mol Cl2与足量的铁反应转移的电子数是3 NA | |
| C. | 常温常压下,15g乙烷分子中含有的共价键键数目为3.5NA | |
| D. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA |
分析 A、盐酸溶液中无HCl分子;
B、氯气和铁反应后变为-1价;
C、求出乙烷的物质的量,然后根据乙烷中含7条共价键来分析;
D、标况下重水为液体.
解答 解:A、HCl溶于水后完全电离,故盐酸溶液中无HCl分子,故A错误;
B、氯气和铁反应后变为-1价,故1mol氯气反应后转移2NA个电子,故B错误;
C、15g乙烷的物质的量为0.5mol,而乙烷中含7条共价键,故0.5mol乙烷中含3.5NA条共价键,故C正确;
D、标况下重水为液体,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
16.现使用酸碱中和滴定法测定市售白醋的总酸量(g•100ml-1).
Ⅰ.实验步骤:
(1)用酸式滴定管(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到转移到容量瓶 (填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol/L NaOH溶液的碱式滴定管的初始读数.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录:
Ⅲ.数据处理与讨论:
(1)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积V=$\frac{(15.95+15.00+15.05+14.95)}{4}$mL=15.24mL.指出他的计算的不合理之处:第1次滴定误差明显大,属异常值,应舍去.
(2)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子交换反应,需查找在一定温度下醋酸和苯甲酸的a(填写序号)
a.电离常数 b.溶解度
(3)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)ab.
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
Ⅰ.实验步骤:
(1)用酸式滴定管(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到转移到容量瓶 (填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol/L NaOH溶液的碱式滴定管的初始读数.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录:
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积V=$\frac{(15.95+15.00+15.05+14.95)}{4}$mL=15.24mL.指出他的计算的不合理之处:第1次滴定误差明显大,属异常值,应舍去.
(2)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子交换反应,需查找在一定温度下醋酸和苯甲酸的a(填写序号)
a.电离常数 b.溶解度
(3)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)ab.
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
17.下列过程一定涉及氧化还原反应的是( )
| A. | 萃取 | B. | 电解 | C. | 净水 | D. | 分馏 |
14.短周期元素W、X、Y、Z的原子序数依次增加.m、n、p是由这些元素组成的二元化合物,W2、X2、Z2分别是元素W、X、Z的单质.已知:
I.一定条件下某密闭容器中可发生反应:aX2+bW2?cm,反应过程中物质的浓度变化如下:
II.它们可发生如下反应:2m(g)+3Z(g)=6n(g)+X2(g);4n(g)+Y2(g) $\frac{\underline{催化剂}}{△}$2p(l)+2Z2(g).下列说法正确的是( )
I.一定条件下某密闭容器中可发生反应:aX2+bW2?cm,反应过程中物质的浓度变化如下:
| X2 | W2 | m | |
| 起始浓度/mol•L-1 | 0.4 | 0.4 | 0 |
| 平衡浓度/mol•L-1 | 0.3 | 0.1 | 0.2 |
| A. | 原子半径:W<X<Y | B. | a:b:c=3:1:2 | ||
| C. | X的氧化物一定是无色气体 | D. | m、n、p三种物质均为共价化合物 |
1.化学知识在生产和生活中有着重要的应用.下列说法中不正确的是( )
| A. | SiO2通常用于通讯行业 | |
| B. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔;而碳酸钠可作医疗上治疗胃酸过多的一种药剂 | |
| C. | 明矾可用作净水剂 | |
| D. | 金属钠可用于冶炼钛等金属 |
4.下列关于电解质的说法正确的是( )
| A. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| B. | 水溶液中导电能力差的电解质一定是弱电解质 | |
| C. | 强电解质在稀的水溶液中全部以离子的形态存在 | |
| D. | 强电解质都是离子化合物,而弱电解质都是共价化合物 |
5. 最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
 最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )| A. | 放电时,负极发生:2AlCl4--e-=Al2Cl3-+Cl- | |
| B. | 充电时,泡沫石墨极与外电源的负极相连 | |
| C. | 放电时,电路中每流过3mol电子,正极减少27g | |
| D. | 充电时,阴极发生:4Al2Cl3-+3e-=Al+7AlCl4- |