题目内容
15.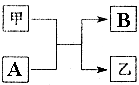 单质A、B与化合物甲、乙有如图所示的转化关系(必要的反应条件未标出),回答下列问题:
单质A、B与化合物甲、乙有如图所示的转化关系(必要的反应条件未标出),回答下列问题:(1)若A、B为日常生活中常见的两种金属,且甲为红棕色粉末,相应的化学方程式为2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ Al2O3+2Fe.乙分别溶解于适量的盐酸和NaOH溶液中,将所得两种溶液加热蒸干并灼烧,最终所得固体的化学式分别是Al2O3、NaAlO2.
(2)若A是黄绿色气体,甲、乙两种气体相遇会产生白烟.甲与A反应的化学方程式为3Cl2+2NH3=N2+6HCl.
分析 (1)若A、B为日常生活中常见的两种金属,且甲为红棕色粉末,则A为Al,甲为Fe2O3,B为Fe,乙为Al2O3;
(2)若A是黄绿色气体,甲、乙两种气体相遇会产生白烟,则A为Cl2,甲为NH3,B为N2,乙为HCl.
解答 解:(1)若A、B为日常生活中常见的两种金属,且甲为红棕色粉末,则A为Al,甲为Fe2O3,B为Fe,乙为Al2O3,化学反应方程式为:2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ Al2O3+2Fe.Al2O3分别溶解于适量的盐酸和NaOH溶液中分别得到氯化铝溶液、偏铝酸钠溶液,氯化铝溶液加热,促进水解,HCl挥发,水解沉淀进行,得到氢氧化铝沉淀,灼烧最终得到Al2O3,偏铝酸钠溶液加热,促进水解,但有氢氧化钠生成,最终氢氧化铝又与氢氧化钠反应,故最终得到固体为NaAlO2,
故答案为:2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ Al2O3+2Fe;Al2O3;NaAlO2;
(2)若A是黄绿色气体,甲、乙两种气体相遇会产生白烟,则A为Cl2,甲为NH3,B为N2,乙为HCl,甲与A反应的化学方程式为:3Cl2+2NH3=N2+6HCl,
故答案为:3Cl2+2NH3=N2+6HCl.
点评 本题考查无机物推断,物质的颜色是推断突破口,熟练掌握元素化合物性质,熟练掌握中学特殊的置换反应等.

练习册系列答案
相关题目
5.饱和二氧化硫水溶液中存在下列平衡体系:
SO2+H2O?H++HSO3-
HSO3-?H++SO3-
若向此溶液中( )
SO2+H2O?H++HSO3-
HSO3-?H++SO3-
若向此溶液中( )
| A. | 加水,SO3-浓度增大 | |
| B. | 通入少量Cl2气体,溶液pH增大 | |
| C. | 加少量CaSO3粉末,HSO3-浓度基本不变 | |
| D. | 通入少量HCl气体,溶液中HSO3-浓度减小 |
6.由分类思想,下列说法正确的是( )
| A. | 氢氧化钠、盐酸都为强电解质 | |
| B. | 铁生锈、食物腐败都有氧化反应发生 | |
| C. | 糖类、蛋白质都为高分子化合物 | |
| D. | 一氯甲烷、二氧化碳都是极性分子 |
3.模拟电渗析法将海水淡化的工作原理示意图如下.已知X、Y均为惰性电极,模拟海水中富含Na+、Cl-、Ca2+、Mg2+、SO42-、HCO3-等离子.下列叙述中正确的是( )


| A. | M是阴离子交换膜 | B. | Y电极上产生无色气体 | ||
| C. | X电极区域可产生Mg(OH)2 | D. | X电极反应式为4OH--4e-═O2↑+2H2O |
10.下列有关说法正确的是( )
| A. | 同周期金属元素的化合价越高,元素的金属性越强 | |
| B. | 海轮外壳上附着一些锌块,可以减缓海轮外壳的腐蚀 | |
| C. | 在含有 BaSO4 沉淀的溶液中加入 Na2SO4固体,c(Ba2+) 增大 | |
| D. | 2NO(g)+2CO(g)═N2(g)+2CO2(g) 在常温下能自发进行,则该反应的△H>0 |
20.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 90 g丙醇中存在的共价键总数为15 NA | |
| B. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol O2转移的电子数为0.2 NA | |
| D. | 2 L 0.5 mol/L亚硫酸溶液中含有的H+离子数为2 NA |
7.下列有关实验原理、操作及安全知识的叙述,正确的是( )
| A. | 不慎将苯酚固体粉末沾在皮肤上,立即用大量热水(>65℃)冲洗 | |
| B. | 银氨溶液、Cu(OH)2悬浊液、氯水在实验室里均不宜长期放置 | |
| C. | 检验C2H5Cl中的氯元素:将C2H5Cl与NaOH溶液混合加热,冷却后加AgNO3溶液 | |
| D. | 同温下用pH试纸测定等浓度的NaClO溶液和CH3COONa溶液的pH,可以证明HClO和CH3COOH的酸性强弱 |
4.汽车已经进入千家万户,汽油来自于石油化工.下列说法不正确的是( )
| A. | 石油中含有1~50个碳原子的烷烃及环烷烃 | |
| B. | 石油分馏是物理变化,裂化、裂解和催化重整属于化学变化 | |
| C. | 石油裂化的目的主要是提高汽油的产量 | |
| D. | 裂化主要是将链烃变为芳香烃 |