题目内容
几种短周期元素的原子半径及主要化合价见下表
(1)写出Y元素的名称 ,确定R在周期表中的位置 .
(2)写出T元素的离子结构示意图 ;W元素的原子结构示意图 .
(3)写出T与P形成的化合物的电子式 .
(4)Z,M,K,T、P的简单离子半径由大到小的顺序是(用化学式表示) .
(5)①写出W单质与P元素的最高价氧化物对应水化物发生反应的化学方程式 .
②写出R单质与WM2在点燃条件下反应的化学方程式 .
| 元素代号 | X | Y | Z | W | M | K | R | T | P |
| 原子半径/pm | 152 | 110 | 143 | 77 | 66 | 99 | 160 | 186 | 104 |
| 主要化合价 | +1 | -3,+5 | +3 | -4,+4 | -2 | -1,+7 | +2 | +1 | -2,+6 |
(2)写出T元素的离子结构示意图
(3)写出T与P形成的化合物的电子式
(4)Z,M,K,T、P的简单离子半径由大到小的顺序是(用化学式表示)
(5)①写出W单质与P元素的最高价氧化物对应水化物发生反应的化学方程式
②写出R单质与WM2在点燃条件下反应的化学方程式
考点:元素周期律和元素周期表的综合应用
专题:
分析:这几种元素都是短周期元素,主族元素中,元素最高正化合价与其族序数相等,最低负化合价=族序数-8,同一主族元素,原子半径随着原子序数增大而增大,同一周期元素,原子半径随着原子序数增大而减小;
根据表中数据知,X、T属于第IA族元素,T原子半径最大,则T为Na,X原子半径不最小,则X为Li元素;
Y位于第VA族、Z位于第IIIA族、W位于第IVA族、M和P位于第VIA族、K位于第VIIA族、R位于第IIA族,
P原子半径大于M,则P为S元素、M为O元素;
K还含有正化合价,则K为Cl元素;
W原子半径稍微大于M,则W为C元素;
Y位于第VA族且原子半径大于W,所以Y为P元素;
Z原子半径大于Y且位于第IIIA族,则Z为Al元素;
R原子半径大于Z,则R是Mg元素;
(1)通过以上分析知,Y是磷元素;R是Mg元素,其原子核外有3个电子层、最外层电子数是2,主族元素中电子层数与其周期数相等、最外层电子数与其族序数相等;
(2)T是Na元素,其离子核外有2个电子层、最外层有8个电子,离子结构示意图为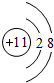 ;W为C元素,C原子核外有2个电子层、最外层有4个电子,原子结构示意图为
;W为C元素,C原子核外有2个电子层、最外层有4个电子,原子结构示意图为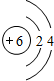 ,
,
故答案为: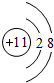 ;
;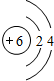 ;
;
(3)T是Na元素、P是S元素,Na和S元素形成的离子化合物硫化钠,其电子式为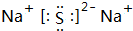 ,故答案为:
,故答案为: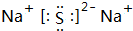 ;
;
(4)离子的电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
(5)①W是C、P的最高价氧化物的水化物是硫酸,浓硫酸和C在加热条件下发生氧化还原反应生成二氧化硫、二氧化碳和水;
②Mg单质与CO2在点燃条件下反应生成C和MgO.
根据表中数据知,X、T属于第IA族元素,T原子半径最大,则T为Na,X原子半径不最小,则X为Li元素;
Y位于第VA族、Z位于第IIIA族、W位于第IVA族、M和P位于第VIA族、K位于第VIIA族、R位于第IIA族,
P原子半径大于M,则P为S元素、M为O元素;
K还含有正化合价,则K为Cl元素;
W原子半径稍微大于M,则W为C元素;
Y位于第VA族且原子半径大于W,所以Y为P元素;
Z原子半径大于Y且位于第IIIA族,则Z为Al元素;
R原子半径大于Z,则R是Mg元素;
(1)通过以上分析知,Y是磷元素;R是Mg元素,其原子核外有3个电子层、最外层电子数是2,主族元素中电子层数与其周期数相等、最外层电子数与其族序数相等;
(2)T是Na元素,其离子核外有2个电子层、最外层有8个电子,离子结构示意图为
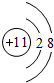 ;W为C元素,C原子核外有2个电子层、最外层有4个电子,原子结构示意图为
;W为C元素,C原子核外有2个电子层、最外层有4个电子,原子结构示意图为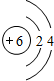 ,
,故答案为:
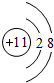 ;
;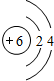 ;
;(3)T是Na元素、P是S元素,Na和S元素形成的离子化合物硫化钠,其电子式为
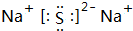 ,故答案为:
,故答案为: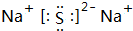 ;
;(4)离子的电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
(5)①W是C、P的最高价氧化物的水化物是硫酸,浓硫酸和C在加热条件下发生氧化还原反应生成二氧化硫、二氧化碳和水;
②Mg单质与CO2在点燃条件下反应生成C和MgO.
解答:
解:这几种元素都是短周期元素,主族元素中,元素最高正化合价与其族序数相等,最低负化合价=族序数-8,同一主族元素,原子半径随着原子序数增大而增大,同一周期元素,原子半径随着原子序数增大而减小;
根据表中数据知,X、T属于第IA族元素,T原子半径最大,则T为Na,X原子半径不最小,则X为Li元素;
Y位于第VA族、Z位于第IIIA族、W位于第IVA族、M和P位于第VIA族、K位于第VIIA族、R位于第IIA族,
P原子半径大于M,则P为S元素、M为O元素;
K还含有正化合价,则K为Cl元素;
W原子半径稍微大于M,则W为C元素;
Y位于第VA族且原子半径大于W,所以Y为P元素;
Z原子半径大于Y且位于第IIIA族,则Z为Al元素;
R原子半径大于Z,则R是Mg元素;
(1)通过以上分析知,Y是磷元素;R是Mg元素,其原子核外有3个电子层、最外层电子数是2,主族元素中电子层数与其周期数相等、最外层电子数与其族序数相等,所以Mg元素位于第三周期第IIA族,
故答案为:磷;第三周期第IIA族;
(2)T是Na元素,其离子核外有2个电子层、最外层有8个电子;W为C元素,C原子核外有2个电子层、最外层有4个电子;
(3)T是Na元素、P是S元素,Na和S元素形成的离子化合物硫化钠;
(4)离子的电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径大小顺序是S2->Cl->O2->Na+>Al3+,故答案为:S2->Cl->O2->Na+>Al3+;
(5)①W是C、P的最高价氧化物的水化物是硫酸,浓硫酸和C在加热条件下发生氧化还原反应生成二氧化硫、二氧化碳和水,反应方程式为C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
②Mg单质与CO2在点燃条件下反应生成C和MgO,反应方程式为2Mg+CO2
C+2MgO,故答案为:2Mg+CO2
C+2MgO.
根据表中数据知,X、T属于第IA族元素,T原子半径最大,则T为Na,X原子半径不最小,则X为Li元素;
Y位于第VA族、Z位于第IIIA族、W位于第IVA族、M和P位于第VIA族、K位于第VIIA族、R位于第IIA族,
P原子半径大于M,则P为S元素、M为O元素;
K还含有正化合价,则K为Cl元素;
W原子半径稍微大于M,则W为C元素;
Y位于第VA族且原子半径大于W,所以Y为P元素;
Z原子半径大于Y且位于第IIIA族,则Z为Al元素;
R原子半径大于Z,则R是Mg元素;
(1)通过以上分析知,Y是磷元素;R是Mg元素,其原子核外有3个电子层、最外层电子数是2,主族元素中电子层数与其周期数相等、最外层电子数与其族序数相等,所以Mg元素位于第三周期第IIA族,
故答案为:磷;第三周期第IIA族;
(2)T是Na元素,其离子核外有2个电子层、最外层有8个电子;W为C元素,C原子核外有2个电子层、最外层有4个电子;
(3)T是Na元素、P是S元素,Na和S元素形成的离子化合物硫化钠;
(4)离子的电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径大小顺序是S2->Cl->O2->Na+>Al3+,故答案为:S2->Cl->O2->Na+>Al3+;
(5)①W是C、P的最高价氧化物的水化物是硫酸,浓硫酸和C在加热条件下发生氧化还原反应生成二氧化硫、二氧化碳和水,反应方程式为C+2H2SO4(浓)
| ||
| ||
②Mg单质与CO2在点燃条件下反应生成C和MgO,反应方程式为2Mg+CO2
| ||
| ||
点评:本题考查元素周期表和元素周期律的综合应用,明确元素化合价、原子半径变化规律是解本题关键,知道离子半径大小比较方法,注意镁能在二氧化碳中燃烧,为易错点.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
硅酸铜钡是当今用最新科学技术才能合成的一种物质.然而现在发现,我国秦朝兵马俑用的一种颜料竟是硅酸铜钡.下列关于硅酸铜钡的说法错误的是( )
| A、易溶于水 | B、难溶于水 |
| C、属于硅酸盐 | D、属于复盐 |
下列物质按一定的分类方法,属于同一类的是( )
| A、标准状况下的状态:O2、CO2、H2O |
| B、酸性氧化物:SO2、Cl2O7、N2O5 |
| C、碱性氧化物:Na2O、CaO、Al2O3 |
| D、混合物:漂白粉、氯水、液氯 |
欲除去铁粉中混有的少量铝粉,应选用的试剂是( )
| A、稀盐酸 | B、稀硝酸 |
| C、硫酸铜溶液 | D、氢氧化钠溶液 |
下列各组物质,前者逐滴滴加到后者中直至过量,先出现白色沉淀,后来沉淀又消失的是( )
| A、AlCl3溶液滴入NaOH溶液中 |
| B、Ba(OH)2溶液滴入Al2(SO4)3溶液中 |
| C、盐酸滴入NaAlO2溶液中 |
| D、氨水滴入AlCl3溶液中 |
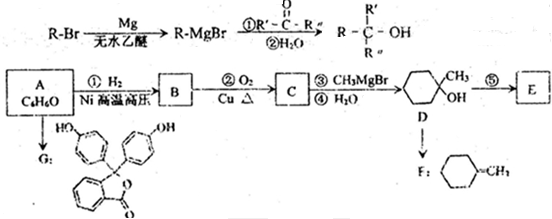
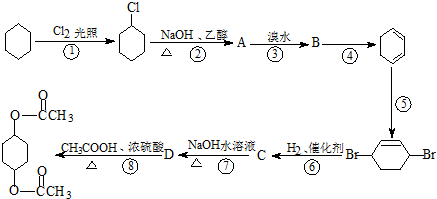
 的合成路线流程图(无机试剂任选),方框内写有机物结构简式,在“→”上或下方写反应所需条件或试剂.
的合成路线流程图(无机试剂任选),方框内写有机物结构简式,在“→”上或下方写反应所需条件或试剂.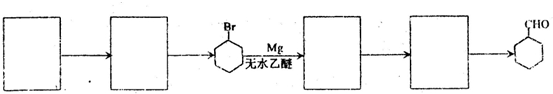
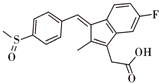 )广发适用于各种关节炎以及各种原因引起的疼痛的临床治疗,它的一种合成路线如下:
)广发适用于各种关节炎以及各种原因引起的疼痛的临床治疗,它的一种合成路线如下:
 备的合成路线.
备的合成路线.