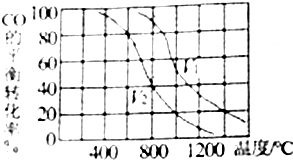
题目内容
4.已知有四种溶液A、B、C、D,分别含有下列阴阳离子:Na+、NH${\;}_{4}^{+}$、Ba2+、Al3+、Cl-、OH-、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$中的各一种,进行下列实验有如下现象:I.A与B、C反应均有气体产生;
Ⅱ.A、C、D两两混合均有沉淀产生.
回答下列问题:
(1)写出A、C的化学式A:(NH4)2CO3 C.Al2(SO4)3.
(2)B与过量的C反应的离子方程式:Al3++3OH-=Al(OH)3↓.
(3)实验室检验D中阴离子需要的试剂:硝酸酸化的硝酸银溶液.
(4)简述用pH试纸测量B溶液pH的方法:将pH试纸放在表面皿上,用洁净干燥的玻璃棒蘸取溶液点在试纸上,待颜色恒定后再与标准比色卡对照.
分析 解答题目的关键是找到突破口.A与B、C反应均有气体产生,而题给离子中只有Al3+与CO32-、OH-与NH4+能反应生成气体,A、C、D两两混合均有沉淀产生,题给离子中CO32-与Al3+和Ba2+反应有沉淀产生,又题给离子中Ba2+只能和Cl-共存于溶液中,故A只能为(NH4)2CO3,C为Al2(SO4)3,D为BaCl2,B为NaOH,以此解答该题.
解答 解:A与B、C反应均有气体产生,而题给离子中只有Al3+与CO32-、OH-与NH4+能反应生成气体,A、C、D两两混合均有沉淀产生,题给离子中CO32-与Al3+和Ba2+反应有沉淀产生,又题给离子中Ba2+只能和Cl-共存于溶液中,故A只能为(NH4)2CO3,C为Al2(SO4)3,D为BaCl2,B为NaOH,
(1)A为(NH4)2CO3,C为Al2(SO4)3,
故答案为:(NH4)2CO3;Al2(SO4)3;
(2)B与过量的C反应,即碱不足,应生成Al(OH)3,
故答案为:Al3++3OH-=Al(OH)3↓;
(3)检验D中阴离子即Cl-共应用硝酸酸化的硝酸银溶液,
故答案为:硝酸酸化的硝酸银溶液;
(4)用pH试纸测量溶液pH的方法为,将pH试纸放在表面皿上,用洁净干燥的玻璃棒蘸取溶液点在试纸上,待颜色恒定后再与标准比色卡对照;
故答案为:将pH试纸放在表面皿上,用洁净干燥的玻璃棒蘸取溶液点在试纸上,待颜色恒定后再与标准比色卡对照.
点评 本题考查离子的检验和推断,题目难度中等,注意解答题目的关键是找到突破口,而本题的突破口为A和C能生成气体又能生成沉淀.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
10.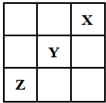 短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
 短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )| A. | Y的氢化物稳定性大于Z的氢化物稳定性 | |
| B. | Z一定是活泼的金属元素 | |
| C. | Y的最高价氧化物的水化物是一种强酸 | |
| D. | 1molX的单质可以跟足量水反应,转移的电子为2mol |
11.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见表:
用10mL H2O2制取150mLO2所需的时间(秒)
(1)该小组在设计方案时.考虑了浓度、催化剂、温度等因素对过氧化氢分解速率的影响.
(2)从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
一般加入催化剂,反应速率加快(或升高温度反应速率加快,降低温度反应速率减慢;增加反应物浓度,反应速率加快,减小反应物浓度,反应速率减慢).
用10mL H2O2制取150mLO2所需的时间(秒)
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 260 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
(2)从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
一般加入催化剂,反应速率加快(或升高温度反应速率加快,降低温度反应速率减慢;增加反应物浓度,反应速率加快,减小反应物浓度,反应速率减慢).
8.实验探究是体验知识的产生或形成过程的基本途径.下面是某同学探究实验报告的一部分,请填空:
实验名称:氯、溴、碘的氧化性强弱比较
实验药品:NaCl溶液、KBr溶液、KI溶液、氯水、溴水、四氯化碳
(1)完成该实验需用到的仪器是试管、量筒、胶头滴管;
(2)②中反应的化学方程式是Cl2+2Br-=2Cl-+Br2;③中反应的离子方程式是Cl2+2I-=2Cl-+I2
(3)CCl4在实验中所起的作用是萃取剂,使生成的Br2、I2溶于其中,便于观察现象;
(4)该同学的实验设计不足之处是不能证明溴的氧化性强于碘;再做一组实验④,步骤为:KI溶液+溴水+1mLCCl4,振荡,静置,观察CCl4层颜色.
实验名称:氯、溴、碘的氧化性强弱比较
实验药品:NaCl溶液、KBr溶液、KI溶液、氯水、溴水、四氯化碳
| 实验步骤 | 实验结论 |
| ①NaCl溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 |
(2)②中反应的化学方程式是Cl2+2Br-=2Cl-+Br2;③中反应的离子方程式是Cl2+2I-=2Cl-+I2
(3)CCl4在实验中所起的作用是萃取剂,使生成的Br2、I2溶于其中,便于观察现象;
(4)该同学的实验设计不足之处是不能证明溴的氧化性强于碘;再做一组实验④,步骤为:KI溶液+溴水+1mLCCl4,振荡,静置,观察CCl4层颜色.
15.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 0.01molFeCl3与沸水反应,形成Fe(OH)3胶粒数目小于0.01NA | |
| B. | 常温下,27g铝片加入足量浓硝酸中,转移的电子数目为3NA | |
| C. | 1mol甲苯含有6NA个C-H键 | |
| D. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
13.下列物质中,能发生水解反应,但不能发生消去反应的是( )
| A. | CH3CH2CH2CH2Cl | B. | CH3CH2Cl | C. | CH3Br | D. | 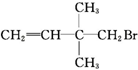 |
14.下列说法正确的是( )
| A. | 日常生活中不能用粥汤检验碘盐中是否含有KIO3 | |
| B. | 减压过滤更适宜过滤胶状沉淀和颗粒较小的沉淀 | |
| C. | 通常用直接蒸馏的方法除去乙醇中的水 | |
| D. | 洗涤沉淀时,应用玻璃棒轻轻搅拌,使沉淀表面上的杂质溶于水中 |