题目内容
8.实验探究是体验知识的产生或形成过程的基本途径.下面是某同学探究实验报告的一部分,请填空:实验名称:氯、溴、碘的氧化性强弱比较
实验药品:NaCl溶液、KBr溶液、KI溶液、氯水、溴水、四氯化碳
| 实验步骤 | 实验结论 |
| ①NaCl溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 |
(2)②中反应的化学方程式是Cl2+2Br-=2Cl-+Br2;③中反应的离子方程式是Cl2+2I-=2Cl-+I2
(3)CCl4在实验中所起的作用是萃取剂,使生成的Br2、I2溶于其中,便于观察现象;
(4)该同学的实验设计不足之处是不能证明溴的氧化性强于碘;再做一组实验④,步骤为:KI溶液+溴水+1mLCCl4,振荡,静置,观察CCl4层颜色.
分析 (1)该实验用量筒量取试剂,可在试管中进行反应;
(2)氯气分别将单质、碘单质从溶液中置换出来;
(3)四氯化碳不参加反应,但卤素单质不易溶于水,易溶于四氯化碳;
(4)不能比较溴、碘的氧化性强弱,以此来解答.
解答 解:由非金属单质间的置换反应来比较单质的氧化性强弱可知,Cl2能置换出Br2、I2,Br2能置换出I2,则说明氧化性Cl2>Br2>I2,
(1)该实验用量筒量取试剂,可在试管中进行反应,还需要胶头滴管滴加液体,故答案为:试管、量筒、胶头滴管;
(2)氯气分别将单质、碘单质从溶液中置换出来,离子方程式为Cl2+2Br-=2Cl-+Br2,Cl2+2I-=2Cl-+I2,故答案为:故答案为:Cl2+2Br-=2Cl-+Br2,
Cl2+2I-=2Cl-+I2;
(3)四氯化碳不参加反应,但卤素单质不易溶于水,易溶于四氯化碳,所以其作用为萃取剂,使生成的Br2、I2溶于其中,便于观察现象,
故答案为:萃取剂,使生成的Br2、I2溶于其中,便于观察现象;
(4)设计的实验中不能证明溴的氧化性强于碘,应再做一组实验④,步骤为:KI溶液+溴水+1mL CCl4,振荡,静置,观察CCl4层颜色,
故答案为:不能证明溴的氧化性强于碘;再做一组实验④,步骤为:KI溶液+溴水+1mL CCl4,振荡,静置,观察CCl4层颜色.
点评 本题考查卤素单质之间的置换反应的实验设计,把握单质的氧化性强弱及现象的分析为解答的关键,涉及氧化还原反应氧化性的比较及萃取等知识点,题目难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
18.下列关于物质性质递变规律的叙述不正确的是( )
| A. | 原子的还原性:K>Na>Mg>Al | |
| B. | 氢化物的稳定性:HCl<H2S<PH3<SiH4 | |
| C. | 酸性:H2CO3<H3PO4<H2SO4<HClO4 | |
| D. | 原子的氧化性:F>Cl>S>P |
16.下列化学式仅代表一种物质的是( )
| A. | CH4 | B. | C3H8 | C. | C4H10 | D. | C5H12 |
3.草毒、香蕉等水果具有芳香气味,是因为其中含有乙酸乙酯(化学式为C4H8O2)等物质,下列关于乙酸乙酷的说法不正确的是( )
| A. | 该物质属于氧化物 | |
| B. | 乙酸与乙醇反应生成乙酸乙酯属于取代反应 | |
| C. | 该物质的相对分子质量为88 | |
| D. | 乙酸乙酯燃烧有二氧化碳和水生成 |
13.下列说法正确的是( )
| A. | “玉兔”月球车上的太阳能电池的材料是硅酸盐 | |
| B. | 利用二氧化碳制造全降解塑料,可以消除温室效应 | |
| C. | 实验室镁着火时,可使用泡沫灭火器灭火 | |
| D. | 可使用氢氧化钠溶液鉴别大豆油与矿物油 |
1.烃的含碳量随碳原子数的增加呈现的一定的递变规律,关于下图的说法错误的是( )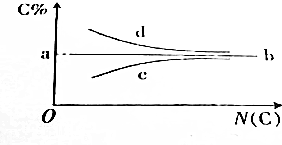

| A. | a点的值肯定是85.7% | B. | 满足b线走势的烃通式为CnH2n | ||
| C. | 满足c线走势的烃一定是烷烃 | D. | 满足d线走势的烃一定是炔烃 |
 酚
酚 羧酸
羧酸 醛
醛 卤代烃
卤代烃 酯.
酯.