题目内容
10.配置一定体积、一定物质的量的浓度的Na2CO3溶液时,下列情况可能使溶液浓度偏低的是( )| A. | 容量瓶内有少量蒸馏水 | |
| B. | 溶液从烧杯中转移到容量瓶时,没有洗涤烧杯 | |
| C. | 定容时观察液面时俯视定容 | |
| D. | 配溶液的Na2CO3•10H2O晶体在空气中久置风化 |
分析 A.容量瓶中事先有水对浓度无影响;
B.没有洗涤烧杯,导致溶质的物质的量减小,并据c=$\frac{n}{V}$分析;
C.定容时观察液面俯视,溶液的液面低于刻度线,导致溶液的体积偏小,并据c=$\frac{n}{V}$分析;
D.配溶液的Na2CO3•10H2O晶体在空气中久置风化,则Na2CO3•10H2O失去结晶水,质量减轻,导致称取的固体中含有碳酸钠的物质的量偏大,溶液浓度偏高.
解答 解:A.容量瓶中事先有水对浓度无影响,故A错误;
B.没有洗涤烧杯,移入容量瓶内导致Na2CO3的物质的量减小,因为c=$\frac{n}{V}$,所以所配溶液浓度偏低,故B正确;
C.定容时观察液面俯视,溶液的液面低于刻度线,导致溶液的体积偏小,根据为c=$\frac{n}{V}$,配得的溶液浓度偏大,故C错误;
D.配溶液的Na2CO3•10H2O晶体在空气中久置风化,则Na2CO3•10H2O失去结晶水,质量减轻,导致称取的固体中含有碳酸钠的物质的量偏大,溶液浓度偏高,故D错误;
故选B.
点评 本题考查了配制一定物质的量浓度溶液,明确配制原理和容量瓶的构造及使用方法是解题关键,题目难度不大.

练习册系列答案
相关题目
18.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 等物质的最浓度的H2S和NaHS混合溶液中:c(Na)+c(H+)=c(S2-)+c(HS-+c(OH-) | |
| B. | 0.2mol/LNH4C1溶液和0.1 mol/LNaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 常温下向20ml0.1mol/LNH4HSO4溶液中滴入同浓度的NaOH溶液至pH=7 c(Na+)>c(SO42-)c(NH4+) | |
| D. | 25℃时,pH=8 的 CH3COONa 稀溶液中,c(CH3COOH)=9.9×10-7mol/L |
5.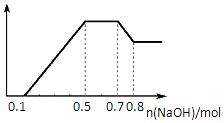 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A. | 溶液中一定不含CO32-,可能含有SO42- | |
| B. | 溶液中n(NH4+)=0.2mol | |
| C. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |
15.A、B、C为短周期元素,在周期表中所处的位置如表所示.
A、C两元素的原子核外电子数之和等于B原子的质子数.
(1)写出B、C元素的名称硫、氟.
(2)B位于元素周期表中第3周期第ⅥA族.
(3)用石墨为电极,电解B元素的最高价氧化物的水化物的水溶液,当电路中转移0.4mol电子时,在阴极收集到的产物是H2,质量为0.4g,电解的总反应方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑;
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式NH3+HNO3═NH4NO3.
| A | C | |
| B |
(1)写出B、C元素的名称硫、氟.
(2)B位于元素周期表中第3周期第ⅥA族.
(3)用石墨为电极,电解B元素的最高价氧化物的水化物的水溶液,当电路中转移0.4mol电子时,在阴极收集到的产物是H2,质量为0.4g,电解的总反应方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑;
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式NH3+HNO3═NH4NO3.
19.1g CH4完全燃烧生成CO2和液态水时放出55.6kJ的热量,该反应的热化学方程式为( )
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-55.6 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-55.6 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6 kJ•mol-1 | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-889.6kJ•mol-1 |


 ;
; ;
;