题目内容
已知:25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;请根据以下信息回答下列问题:
25℃时,将20mL0.10mol?L-1CH3COOH溶液和20mL0.10mol?L-1HSCN溶液分别与20mL0.10mol?L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图所示:
代表醋酸与NaHCO3溶液反应的曲线是 (填写A或B),反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”),
在25℃下,将amol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显 性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb= .
25℃时,将20mL0.10mol?L-1CH3COOH溶液和20mL0.10mol?L-1HSCN溶液分别与20mL0.10mol?L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图所示:
代表醋酸与NaHCO3溶液反应的曲线是
在25℃下,将amol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显

考点:弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算
专题:
分析:反应速率与氢离子浓度成正比,酸的电离平衡常数越大,酸的电离程度越大则酸的酸性越强,其酸根水解能力越小;在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3?H2O的电离常数Kb=
.
| c(OH-)?c(H+) |
| c(NH3?H2O) |
解答:
解:酸的电离平衡常数越大,酸的电离程度越大则酸的酸性越强,其酸根水解能力越小,硫氰酸的电离平衡常数大于醋酸,所以硫氰酸的反应速率快,B曲线代表醋酸与NaHCO3溶液反应;硫氰酸的电离平衡常数大于醋酸,所以醋酸根离子的水解能力大于硫氰酸根离子,则c(CH3COO-)<c(SCN-);将amol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),根据电荷守恒,则c(H+)=c(OH-),在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3?H2O的电离常数Kb=
=
=
,
故答案为:B;<2;中;
.
| c(OH-)?c(H+) |
| c(NH3?H2O) |
| 10-7×5×10-3 |
| 0.5a-5×10-3 |
| 10-9 |
| a-0.01 |
故答案为:B;<2;中;
| 10-9 |
| a-0.01 |
点评:本题考查了弱电解质的电离、盐类水解等知识点,明确弱电解质电离特点及酸的电离平衡常数与酸性强弱的关系是解本题关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列图示实验操作正确的是( )
A、 |
B、 |
C、 |
D、 |
将Mg、Al、Zn组成的混合物与足量的盐酸作用,放出H2的体积为2.8L(标准状况下),则这三种金属的物质的量之和可能为( )
| A、0.250 mol |
| B、0.125 mol |
| C、0.100 mol |
| D、0.080 mol |
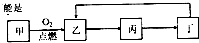 甲~丁是含同一种元素的四种物质,甲和丁分别是该元素的单质和最高价氧化物的水化物,它们之间有如图所示的转化关系,甲不可能是( )
甲~丁是含同一种元素的四种物质,甲和丁分别是该元素的单质和最高价氧化物的水化物,它们之间有如图所示的转化关系,甲不可能是( )| A、Fe | B、Si | C、Al | D、S |
 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理示意图如图,下列说法正确的是( )
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理示意图如图,下列说法正确的是( )| A、A电源的负极 |
| B、阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O |
| C、阴极区附近溶液的pH降低 |
| D、若不考虑气体的溶解,当收集到H213.44L时有0.1molCr2O72-被还原 |
下列烷烃在光照下与氯气反应,生成3种一氯代烃的是( )
| A、CH3CH2CH2CH3 |
| B、CH3CH(CH3)CH3 |
| C、(CH3)3CCH2CH3 |
| D、CH(CH3)2CH2CH3 |