题目内容
17.要检验某溴乙烷中的溴元素,正确的实验方法是( )| A. | 加入氯水振荡,观察水层是否有棕红色出现 | |
| B. | 滴入AgNO3溶液,再加入稀硝酸,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,然后加入稀硝酸使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 |
分析 检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,据此即可解答.
解答 解:检验溴乙烷中含有溴元素首先将它转化为溴离子,采用卤代烃的水解方法,即加入氢氧化钠,在水解后生成的溴离子可以和银离子反应,生成淡黄色不溶于硝酸的沉淀溴化银,由此来检验溴乙烷中的溴元素,所以操作为:加入NaOH溶液,加热,溴乙烷在碱性条件下水解生成溴化钠和乙醇,冷却,加入稀HNO3酸化后加入AgNO3溶液,溴离子和银离子反应生成淡黄色不溶于硝酸的溴化银沉淀.
故选C.
点评 本题是一道考查检验某溴乙烷中的溴元素的实验题,考查实验分析能力,依据相关实验证实即可解答,难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
5.元素周期表是一座开放的“元素大厦”,“元素大厦”尚未客满.若发现第120号元素,请在“元素大厦”中安排好它的“房间”是( )
| A. | 第七周期0族 | B. | 第六周期第IA族 | C. | 第八周期第ⅡA族 | D. | 第七周期第ⅦA族 |
6.下列关于皂化反应的说法中.错误的是( )
| A. | 油脂经皂化反应后,生成高级脂肪酸钠,甘油和水形成混合液 | |
| B. | 加入食盐可以使肥皂析出,这一过程叫盐析 | |
| C. | 加入食盐搅拌后,静置一段时间,溶液分成上下两层,下层是高级脂肪酸钠 | |
| D. | 皂化反应后的混合溶液中加入食盐,可以通过过滤的方法分离提纯 |
5.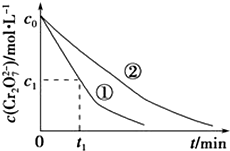 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格).
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示.
(2)上述反应后草酸被氧化的离子方程式为Cr2O72-+3H2C2O4+8H+=6CO2↑+2Cr3++7H2O
(3)实验①和②的结果表明溶液PH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;
…
(5)请你设计实验验证上述假设一,完成下表中内容.
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格).
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
(2)上述反应后草酸被氧化的离子方程式为Cr2O72-+3H2C2O4+8H+=6CO2↑+2Cr3++7H2O
(3)实验①和②的结果表明溶液PH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;
…
(5)请你设计实验验证上述假设一,完成下表中内容.
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 用等物质的量K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后,若溶液中c(Cr2O72-)大于实验①中c(Cr2O72-),则假设一成立;若两溶液中的c(Cr2O72-)相同,则假设一不成立 |
2.元素的性质随着原子序数的递增呈现周期性变化的主要原因是( )
| A. | 元素原子的核外电子排布呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素原子的金属性、非金属性呈周期性变化 | |
| D. | 元素的原子半径呈周期性变化 |
9.下列过程不是原电池工作原理的是( )
| A. | 析氢腐蚀 | B. | 牺牲阳极的阴极保护法 | ||
| C. | 吸氧腐蚀 | D. | 外加电流的阴极保护法 |
6.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 氧化钙溶于水 | B. | 铁粉溶于稀硫酸 | ||
| C. | 盐酸与氢氧化钠反应 | D. | 氢氧化钡晶体与氯化铵晶体混合 |
7.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 反应物总能量低于生成物总能量时,该反应一定不能发生 | |
| B. | 化学键的键能越大,物质的能量越高 | |
| C. | 一个反应的焓变因反应物的用量和反应条件的改变而发生改变 | |
| D. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 |