题目内容
16.设NA为阿伏加德罗常数的值,下列叙述中指定粒子数目一定小于NA的是( )| A. | 含1molNa2CO3的溶液中CO32-的微粒数目 | |
| B. | 常温常压下,22.4 L N2的原子数目 | |
| C. | 46gNO2和N2O4的混合气体中的原子数 | |
| D. | 28g铁在反应中作还原剂时,失去电子的数目 |
分析 A、碳酸根是弱酸根,在溶液中会水解;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、NO2和N2O4的最简式均为NO2;
D、铁反应后可能变为+3价,也可能变为+2价.
解答 解:A、碳酸根是弱酸根,在溶液中会水解,故溶液中的碳酸根的个数小于NA个,故A正确;
B、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L氮气的物质的量小于1mol,而氮气为双原子分子,故含有的原子小于2NA个,故B错误;
C、NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,则含3NA个原子,故C错误;
D、28g铁的物质的量为0.5mol,而铁反应后可能变为+3价,也可能变为+2价,故0.5mol铁失去电子数可能为NA个,也可能为1.5NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列有关叙述正确的是( )
| A. | 因为C和Si是同主族元素,故CO2和SiO2形成的晶体相同 | |
| B. | 在晶体中有阳离子就一定有阴离子 | |
| C. | 由于水分子间可以形成氢键故水分子的稳定性很强 | |
| D. | 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键 |
4.下列各种规律描述正确的是( )
| A. | 第ⅠA 族元素单质的熔点随着原子序数递增而升高 | |
| B. | 卤族元素单质的熔点随着原子序数递增而升高 | |
| C. | 第ⅤA族元素的气态氢化物沸点随着原子序数递增而升高 | |
| D. | 第三周期元素形成的简单离子半径随着原子序数递增而增大 |
11.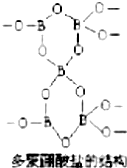 有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )
有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )
 有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )
有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )| A. | 3,9 | B. | 2,4 | C. | 2,5 | D. | 3,6 |
1.有M、X、Y、Z、W五种原子序数依次增大的短周期主族元素,其中M、Z同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法正确的是( )
| A. | X、M两种元素形成的化合物中只能存在离子键 | |
| B. | 元素Z的某种氧化物具有漂白性,是因为这种氧化物具有强氧化性 | |
| C. | 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 | |
| D. | 元素W和M的某些单质可作为水处理中的消毒剂 |
8.常温下,下列金属制成的容器能盛放浓硝酸的是( )
| A. | 铝 | B. | 镁 | C. | 铜 | D. | 银 |
5.元素周期表是一座开放的“元素大厦”,“元素大厦”尚未客满.若发现第120号元素,请在“元素大厦”中安排好它的“房间”是( )
| A. | 第七周期0族 | B. | 第六周期第IA族 | C. | 第八周期第ⅡA族 | D. | 第七周期第ⅦA族 |
6.下列关于皂化反应的说法中.错误的是( )
| A. | 油脂经皂化反应后,生成高级脂肪酸钠,甘油和水形成混合液 | |
| B. | 加入食盐可以使肥皂析出,这一过程叫盐析 | |
| C. | 加入食盐搅拌后,静置一段时间,溶液分成上下两层,下层是高级脂肪酸钠 | |
| D. | 皂化反应后的混合溶液中加入食盐,可以通过过滤的方法分离提纯 |