题目内容
3.铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:(1)生铁中含有一种铁碳化合物X(Fe3C).X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是Fe3+、Fe2+、H+.
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是BC.
A.Mg2+B.Fe2+C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
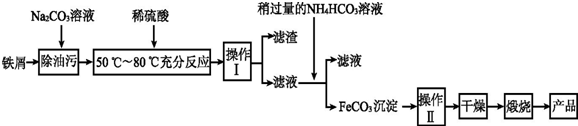
回答下列问题:
①操作Ⅰ的名称是过滤,操作Ⅱ的名称是洗涤;
②写出在空气中煅烧FeCO3的化学方程式4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定
(5Fe2++Mn${O}_{4}^{-}$+8H+═5Fe3++Mn2++4H2O).
a.称取2.850 g绿矾(FeSO4•7H2O)产品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.010 00 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL.
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需250mL容量瓶.
②判定反应是否需要指示剂(如果需要,选择何种指示剂,请描述现象.如果不需要,请说明理由,请描述现象)不需要,可以利用高锰酸钾颜色变化指示滴定终点.
③计算上述样品中FeSO4•7H2O的质量分数为97.5%.
分析 (1)有磁性的固体Y为四氧化三铁,与盐酸反应生成氯化铁、氯化亚铁;
(2)加入过量的NaOH,Al3+转化为偏铝酸根,Mg2+、Fe2+、Cu2+转化为氢氧化物沉淀,且氢氧化亚铁易被氧化,灼烧固体得到氧化镁、氧化铜、氧化铁,加入到过量的稀盐酸中,所得溶液中含有Mg2+、Fe3+、Cu2+;
(3)由流程可知,碳酸钠水解显碱性,可除去油污,然后Fe与硫酸反应生成硫酸亚铁和氢气,操作I为过滤,滤液中亚铁离子与碳酸氢铵反应生成FeCO3,操作II为洗涤,干燥后煅烧FeCO3得到Fe2O3;
(4)①一定物质的量浓度溶液的配制结合配制步骤可得到每一步中使用的仪器,很明显缺少250 mL容量瓶;
②酸性高锰酸钾溶液呈紫红色,随着反应溶液颜色会发生改变,故不需要指示剂,可以利用高锰酸钾颜色变化指示滴定终点;
③结合反应的化学方程式可得亚铁离子和高锰酸根物质的量之比为5:1,以此计算.
解答 解:(1)Fe3C在足量的空气中高温煅烧,生成有磁性的固体Y,Y为Fe3O4,溶于过量的盐酸反应生成氯化亚铁、氯化铁,溶液有剩余的HCl,溶液中大量存在的阳离子是Fe2+、Fe3+、H+,故答案为:Fe3+、Fe2+、H+;
(2)加入过量的NaOH,Al3+转化为偏铝酸根,Mg2+、Fe2+、Cu2+转化为氢氧化物沉淀,且氢氧化亚铁易被氧化,灼烧固体得到氧化镁、氧化铜、氧化铁,加入到过量的稀盐酸中,所得溶液中含有Mg2+、Fe3+、Cu2+,与原溶液相比,溶液中大量减少的阳离子是Al3+、Fe2+,
故答案为:BC;
(3)由流程可知,碳酸钠水解显碱性,可除去油污,然后Fe与硫酸反应生成硫酸亚铁和氢气,操作I为过滤,滤液中亚铁离子与碳酸氢铵反应生成FeCO3,操作II为洗涤,干燥后煅烧FeCO3得到Fe2O3;
①由上述分析可知,操作I、II分别为过滤、洗涤,故答案为:过滤;洗涤;
②在空气中煅烧FeCO3的化学方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
(4)①一定物质的量浓度溶液的配制结合配制步骤可得到每一步中使用的仪器,很明显缺少250 mL容量瓶,故答案为:250 mL容量瓶;
②酸性高锰酸钾溶液呈紫红色,随着反应溶液颜色会发生改变,故不需要指示剂,可以利用高锰酸钾颜色变化指示滴定终点,故答案为:不需要,可以利用高锰酸钾颜色变化指示滴定终点;
③结合反应的化学方程式可得亚铁离子和高锰酸根物质的量之比为5:1,则七水硫酸亚铁的质量分数为$\frac{0.01mol/L×0.2L×5×278g/mol×\frac{250}{25}}{2.85g}$×100%=97.5%,
故答案为:97.5%.
点评 本题考查物质制备实验及含量测定计算,为高频考点,把握制备实验流程、物质的性质、反应中的物质的量关系为解答的关键,侧重分析与实验、计算能力的综合考查,题目难度中等.

| A. | 铁和酸反应,放出标准状况下的22.4L气体,转移的电子数必为2NA | |
| B. | 将标准状况下,11.2LN2和33.6LH2混合,在一定条件下充分反应,产生的NH3的分子数为2NA | |
| C. | 常温常压下,6g乙酸所含共价键数目为0.7NA | |
| D. | 1L 0.1mol•L-1碳酸钠溶液中,阴离子数目大于0.1NA |
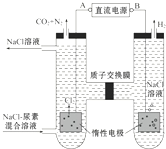
| A. | B为电源的正极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将升高 | |
| C. | 电子移动的方向是B→右侧惰性电极→质子交换膜→左侧惰性电极→A | |
| D. | 阳极室中发生的反应依次为2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl |
| A. | 是天然气的主要成分 | B. | 不能使稀的酸性高锰酸钾溶液褪色 | ||
| C. | 是一种植物生长调节剂 | D. | 是聚乙烯塑料袋的主要成分 |
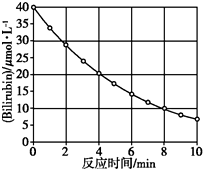 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )| A. | 2.5 μmol/( L•min)和2.0 μmol/L | B. | 2.5 μmol/( L•min)和2.5 μmol/L | ||
| C. | 3.0 μmol/( L•min)和3.0 μmol/L | D. | 5.0 μmol/( L•min)和3.0 μmol/L |
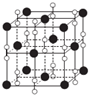 (1)已知KCl、MgO、CaO、TiN这四种晶体的结构与NaCl晶体结构相似.下表给出了三种晶体的晶格能数据:
(1)已知KCl、MgO、CaO、TiN这四种晶体的结构与NaCl晶体结构相似.下表给出了三种晶体的晶格能数据:| 晶体 | NaCl | KCl | CaO |
| 晶格能(kJ•mol-1) | 786 | 715 | 3401 |
(2)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构与NaCl相同(如图所示).据此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是pg•cm-3,则晶胞内最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{72×4}{ρ•{N}_{A}}}$ cm(只要求列出算式,不必计算出数值结果,阿伏加德罗常数的值为NA).
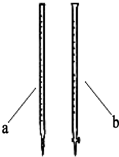 某学校研究性学习小组开展课题探究:
某学校研究性学习小组开展课题探究:探究课题Ⅰ.“不同条件对化学反应速率影响的探究”,选用4mL 0.01mol•L-1KMnO4溶液与2mL 0.1mol•L-1 H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
| 组别 | 草酸的体积(mL) | 温度/℃ | 其他物质 |
| ?① | 2mL | 20 | |
| ?② | 2mL | 20 | 10滴饱和MnSO4溶液 |
| ?③ | 2mL | 30 | |
| ④ | 1mL | 20 | 1mL蒸馏水 |
(2)对比实验①和④,可以研究硫酸的浓度或氢离子浓度对化 学反应速率的影响,实验④中加入1mL蒸馏水的目的是确保①和④组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变.
探究课题Ⅱ.该小组查阅资料得知:C2O42-+MnO4-+H+→CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数.该小组称量1.34g草酸钠样品溶于稀硫酸中,然后用0.200mol•L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应).
(1)滴定前是否要滴加指示剂?否(填“是”或“否”),请说明理由KMnO4溶液呈紫红色,达滴定终点紫色不再褪去.
(2)滴定时用b(填a或b)滴定管盛装KMnO4标准溶液.
(3)达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为75%.