题目内容
15.某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转.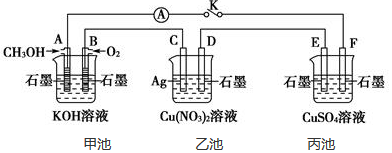
请回答下列问题:
(1)甲池为原电池(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O.
(2)丙池中F电极为阴极(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应的化学方程式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4.
(3)当池中D极质量增重10.8g时,甲池中B电极理论上消耗O2的体积为560mL(标准状况).
(4)已知丙池中的溶液为400mL,合上开关K,一段时间后,丙池中,阳极共收集到气体224mL(标准状况下)气体,则此时溶液的pH为1.
分析 (1)甲池为原电池,燃料在负极失电子发生氧化还原反应在碱溶液中生成碳酸盐,结合电荷守恒写出电极反应;
(2)丙池是电解池,丙池中F电极与负极相连为阴极,电池中是电解硫酸铜溶液生成铜,硫酸和氧气;
(3)乙池是电解池结合电子守恒计算消耗氧气的体积;
(4)丙池是电解池,阳极为氢氧根离子失电子发生氧化反应生成氧气,据此计算剩余氢离子浓度从而计算溶液的pH.
解答 解:(1)甲池为原电池,燃料在负极失电子发生氧化还原反应在碱溶液中生成碳酸盐,甲池中通入CH3OH电极的电极反应为:CH3OH-6e-+8OH-═CO32-+6H2O,故答案为:原电池;CH3OH-6e-+8OH-═CO32-+6H2O;
(2)丙池是电解池,丙池中F电极与负极相连为阴极,电池中是电解硫酸铜溶液生成铜,硫酸和氧气,电池反应为:2CuSO4+2H2O $\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,
故答案为:阴极;2CuSO4+2H2O $\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;
(3)当乙池中D极质量增重10.8g即析出10.8gAg,物质的量=$\frac{10.8g}{108g/mol}$=0.1mol,依据电子守恒计算4Ag~O2~4e-,甲池中理论上消耗O2的体积=$\frac{0.1}{4}$mol×22.4L/mol=0.56L=560ml;故答案为:560;
(4)丙池是电解池,阳极为氢氧根离子失电子发生氧化反应生成氧气,则根据4OH-~O2~4e-,则消耗氢氧根离子n=$\frac{0.224L}{22.4L/mol}$×4=0.04mol,所以剩余氢离子浓度为$\frac{0.04mol}{0.4L}$=0.1mol/L,则pH为1;
故答案为:1.
点评 本题考查了原电池电解池的相互串联问题,注意首先区分原电池和电解池,题目难度中等.

| A. | 硫酸氢钠溶液和过量的Ba(OH)2溶液反应SO42-+H++Ba2++OH-=BaSO4↓+H2O | |
| B. | 碳酸氢钠水解:HCO3-+H2O=CO32-+H3O+ | |
| C. | 氯气和水反应:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 用铂电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- |
| A. | 在蒸发皿中放入NaCl溶液,加热、蒸发得到NaCl晶体 | |
| B. | 用10 mL的量筒量取5.2 mL的盐酸 | |
| C. | 用托盘天平称取25.20 g NaCl | |
| D. | 用1 000 mL容量瓶配制450 mL 0.1 mol•L-1的盐酸 |
| A. | 合成NH3反应,为提高NH3的产率,理论上应采取相对较低的温度 | |
| B. | 实验室中常用排饱和食盐水的方式收集氯气 | |
| C. | 对于CO(g)+NO2(g)?CO2(g)+NO(g)的平衡体系,增大压强可使颜色变深 | |
| D. | 对熟石灰的悬浊液加热,悬浊液中固体质量增加 |
| A. | 在标准状况下,22.4L水所含分子数目为NA | |
| B. | 1mol•L-1 K2SO4溶液中所含K+数目为2NA | |
| C. | 1 mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为N A | |
| D. | O2的摩尔体积约为22.4 L•mol-1 |
| A. | Na2CO3俗称纯碱,属于盐类,可用于洗涤油污等 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | MgO的熔点很高,可用于制作耐高温材料 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
