题目内容
某化学实验兴趣小组在“探究氯水与溴化亚铁溶液反应”的实验中发现:“在足量的溴化亚铁溶液中,加入1~2滴氯水,振荡后溶液呈黄色.”根据已有化学知识及资料,请你对上述现象形成原因进行分析与探究:
(1)提出问题猜想:
溶液呈黄色是因发生离子反应①2Fe2++Cl2=2Fe3++2Cl-所致.溶液呈黄色是因发生离子反应② (填离子方程式)所致.
(2)设计实验并验证
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验.请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
(3)实验结论:以上实验不仅验证了溶液变黄的真实原因,同时证明了Fe2+的还原性比Br-(填“强”、“弱”、“几乎一致”).
(4)实验反思
Ⅰ.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是 .
Ⅱ.在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有
的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 mol?L-1.
(1)提出问题猜想:
溶液呈黄色是因发生离子反应①2Fe2++Cl2=2Fe3++2Cl-所致.溶液呈黄色是因发生离子反应②
(2)设计实验并验证
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验.请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
| 试剂 | 酚酞试液、CCl4、无水酒精、KSCN溶液 | ||
| 方案 | 操作步骤 | 实验现象 | 结论 |
| 1 | 取所述黄色溶液于试管中,滴加并振荡 | 溶液变红色 | |
| 2 | 取所述黄色溶液于试管中,滴加并振荡 | (同上) | |
(4)实验反思
Ⅰ.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是
Ⅱ.在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有
| 1 |
| 2 |
考点:氯、溴、碘的性质实验
专题:实验设计题
分析:(1)②根据溴水的颜色来进行猜想;
(2)利用Fe3+的检验及萃取来进行实验的设计,Fe3+遇KSCN溶液变为红色,溴易溶于四氯化碳中,且四氯化碳与水不溶;
(3)由氧化性Br2>Fe3+,则氯化亚铁溶液中加入1~2滴溴水发生氧化还原反应生成Fe3+;
(4)Ⅰ.依据溴在四氯化碳中易溶回答;
Ⅱ.根据电子守恒进行计算.
(2)利用Fe3+的检验及萃取来进行实验的设计,Fe3+遇KSCN溶液变为红色,溴易溶于四氯化碳中,且四氯化碳与水不溶;
(3)由氧化性Br2>Fe3+,则氯化亚铁溶液中加入1~2滴溴水发生氧化还原反应生成Fe3+;
(4)Ⅰ.依据溴在四氯化碳中易溶回答;
Ⅱ.根据电子守恒进行计算.
解答:
解:(1)②因溴水的颜色为黄色,则溶液呈黄色是因为含有Br2所致,根据溴水的颜色来进行猜想,故答案为:2Br-+Cl2=Br2+2Cl-;
(2)因Fe3+遇KSCN溶液变为红色,溴易溶于四氯化碳中,且四氯化碳与水不溶,故答案为:
(3)由氧化性Br2>Fe3+,则Fe2+的还原性比Br-强,故答案为:强;
(4)I.根据Fe2+的还原性比Br-强,若在溴化亚铁溶液中滴入足量氯水,则氯气会先和亚铁离子反应,再和溴离子反应,生成三价铁和溴单质,再加入CCl4并充分振
荡后静止,溴单质溶解于四氯化碳中,显示橙红色,水和四氯化碳是互不相溶的,三价铁溶解在水中,显示黄色,所以产生的现象是:溶液分上下两层,上层为黄色、下层为橙红色,故答案为:溶液分上下两层,上层为黄色、下层为橙红色;
Ⅱ.设FeBr2的物质的量浓度为c,由电子守恒可知,
×2×1=c×0.1L×(3-2)+c×0.1L×2×
×(1-0),解得c=1mol/L,
故答案为:1.
(2)因Fe3+遇KSCN溶液变为红色,溴易溶于四氯化碳中,且四氯化碳与水不溶,故答案为:
| 方案 | 操作步骤 | 实验现象 | 结论 |
| 1 | KSCN溶液 | ① | |
| 2 | CCl4 | 溶液分上下两层,上层为黄色、下层为无色 |
(4)I.根据Fe2+的还原性比Br-强,若在溴化亚铁溶液中滴入足量氯水,则氯气会先和亚铁离子反应,再和溴离子反应,生成三价铁和溴单质,再加入CCl4并充分振
荡后静止,溴单质溶解于四氯化碳中,显示橙红色,水和四氯化碳是互不相溶的,三价铁溶解在水中,显示黄色,所以产生的现象是:溶液分上下两层,上层为黄色、下层为橙红色,故答案为:溶液分上下两层,上层为黄色、下层为橙红色;
Ⅱ.设FeBr2的物质的量浓度为c,由电子守恒可知,
| 2.24L |
| 22.4L/mol |
| 1 |
| 2 |
故答案为:1.
点评:本题考查氧化还原反应及氧化性、还原性的比较、实验设计,学生应注意物质的性质及氧化还原反应中电子守恒来分析,难度不大.

练习册系列答案
相关题目
下列元素的第一电离能依次减小的是( )
| A、H、Li、Na、K |
| B、I、Br、Cl、F |
| C、Na、Mg、Al、Si |
| D、Si、Al、Mg、Na |
某组成为C5H12O的醇可被氧化成为C5H10O2的酸,具有这种结构的醇的同分异构体共有( )
| A、2种 | B、4种 | C、8种 | D、14种 |
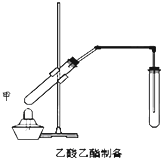 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答: