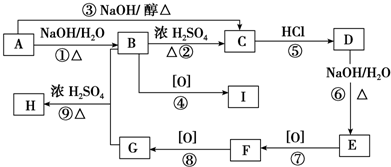
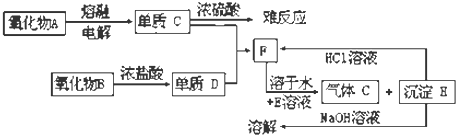
题目内容
MnO2、KMnO4等是中学化学中的常用试剂.请回答下列问题:
(1)MnO2在H2O2分解反应中作催化剂.若将MnO2加入酸化的H2O2溶液中,MnO2溶解产生Mn2+,反应的离子方程式是 .
(2)用MnO2制KMnO4的工艺流程如下
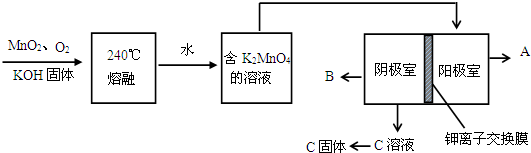
电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4.
①写出240℃熔融时发生反应的化学方程式 ,投料时必须满足n(KOH):n(MnO2) .
②阳极的电极反应为 .
③B物质是 (写化学式,下同),可以循环使用的物质是 .
④钾离子交换膜的一种材料是聚丙烯酸钾(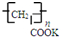 ),聚丙烯酸钾单体的结构简式为 .
),聚丙烯酸钾单体的结构简式为 .
⑤上述制得的KMnO4产品0.165g,恰好与0.335g经硫酸酸化的Na2C2O4反应完全,该KMnO4的纯度是 (精确到0.1%).
(1)MnO2在H2O2分解反应中作催化剂.若将MnO2加入酸化的H2O2溶液中,MnO2溶解产生Mn2+,反应的离子方程式是
(2)用MnO2制KMnO4的工艺流程如下

电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4.
①写出240℃熔融时发生反应的化学方程式
②阳极的电极反应为
③B物质是
④钾离子交换膜的一种材料是聚丙烯酸钾(
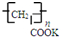 ),聚丙烯酸钾单体的结构简式为
),聚丙烯酸钾单体的结构简式为⑤上述制得的KMnO4产品0.165g,恰好与0.335g经硫酸酸化的Na2C2O4反应完全,该KMnO4的纯度是
考点:制备实验方案的设计
专题:实验设计题
分析:(1)双氧水具有还原性,二氧化锰具有氧化性,二者在酸性环境下发生氧化还原反应;
(2)①根据流程中的反应物和产物结合化学方程式的书写来回答,为保证锰元素的利用率,应该保证一方过量;
②在电解池的阳极上发生失电子的氧化反应;
③根据反应确定得到的物质以及可以循环使用的物质;
④两个碳原子链结的高分子化合物的单体是单键闭合,形成碳碳双键即可;
⑤根据高锰酸钾和草酸钠之间反应的电子守恒,找到二者之间量的关系进行计算回答.
(2)①根据流程中的反应物和产物结合化学方程式的书写来回答,为保证锰元素的利用率,应该保证一方过量;
②在电解池的阳极上发生失电子的氧化反应;
③根据反应确定得到的物质以及可以循环使用的物质;
④两个碳原子链结的高分子化合物的单体是单键闭合,形成碳碳双键即可;
⑤根据高锰酸钾和草酸钠之间反应的电子守恒,找到二者之间量的关系进行计算回答.
解答:
解:(1)双氧水具有还原性,在酸性环境下,得到的氧化产物是氧气,二氧化锰具有氧化性,在酸性环境下,得到还原产物是锰离子,二者在酸性环境下发生氧化还原反应,反应的离子方程式为:MnO2+2H++H2O2═Mn2++O2↑+2H2O,故答案为:MnO2+2H++H2O2═Mn2++O2↑+2H2O;
(2)用MnO2制KMnO4的工艺流程:二氧化锰、氢氧化钾以及氧气在240℃下反应可以得到锰酸钾,氢氧化钾、氧气过量,可以保证锰元素的全部转化,将得到的高锰酸钾溶于水,可以得到高锰酸钾的水溶液,对其进行电解,获得较大浓度的高锰酸钾溶液,
①240℃熔融时发生反应的化学方程式为:2MnO2+O2+4KOH
2K2MnO4+2H2O,氢氧化钾、氧气过量,可以保证锰元素的全部转化,投料时必须满足n(KOH):n(MnO2)大于2:1,故答案为:2MnO2+O2+4KOH
2K2MnO4+2H2O;大于(或>)2:1;
②在电解池的阳极上是锰酸钾中的阴离子失电子的过程,即MnO42--e-=MnO4-,故答案为:MnO42--e-=MnO4-;
③在电解池的阴极上是氢离子得电子,在该极上会产生氢气,在流程中,电解产物氢氧化钾可以在开始接着利用,即可以循环使用,故答案为:H2,KOH固体;
④两个碳原子链结的高分子化合物的单体是单键闭合,形成碳碳双键即可,即单体是:CH2=CHCOOK,故答案为:CH2=CHCOOK;
⑤设该KMnO4的纯度为y,根据2KMnO4+5Na2C2O4+8H2SO4
K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O可知,
KMnO4--Na2C2O4
×158 134
0.165×y 0.335
y=
×100%=95.8%,故答案为:95.8%.
(2)用MnO2制KMnO4的工艺流程:二氧化锰、氢氧化钾以及氧气在240℃下反应可以得到锰酸钾,氢氧化钾、氧气过量,可以保证锰元素的全部转化,将得到的高锰酸钾溶于水,可以得到高锰酸钾的水溶液,对其进行电解,获得较大浓度的高锰酸钾溶液,
①240℃熔融时发生反应的化学方程式为:2MnO2+O2+4KOH
| ||
| ||
②在电解池的阳极上是锰酸钾中的阴离子失电子的过程,即MnO42--e-=MnO4-,故答案为:MnO42--e-=MnO4-;
③在电解池的阴极上是氢离子得电子,在该极上会产生氢气,在流程中,电解产物氢氧化钾可以在开始接着利用,即可以循环使用,故答案为:H2,KOH固体;
④两个碳原子链结的高分子化合物的单体是单键闭合,形成碳碳双键即可,即单体是:CH2=CHCOOK,故答案为:CH2=CHCOOK;
⑤设该KMnO4的纯度为y,根据2KMnO4+5Na2C2O4+8H2SO4
| ||
| 2 |
| 5 |
| 2 |
| 5 |
0.165×y 0.335
y=
0.335×
| ||
| 134×0.165 |
点评:本题考查本题考查常见氧化剂与还原剂、氧化还原反应中的化学计算和工艺流程的理解,解答本题时要充分理解图中提供的信息,理解了图中信息能对问题做出正确的判断,题目难度大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
为鉴别某白色纺织物的成分是蚕丝还是人造丝,通常选用的方法是( )
| A、滴加醋酸 | B、滴加浓硫酸 |
| C、滴加酒精 | D、火焰上灼烧 |
化学与生活密切相关.下列说法不正确的是( )
| A、氧化铁常用作红色油漆和涂料 |
| B、硅胶可作袋装食品的干燥剂 |
| C、二氧化硅是将太阳能转化为电能的常用材料 |
| D、氢氧化铝可作胃酸的中和剂 |
将常温下pH=12的氢氧化钠溶液与pH=2的硫酸溶液分别加热,溶液pH的变化是( )
| A、前者减少后者不变 |
| B、前者减小后者增大 |
| C、都不变 |
| D、都减小 |