题目内容
A、B、C、D四种元素,A元素形成的-2价阴离子比氦的核外电子数多8个.B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质.C为第三周期的第IIA族金属元素.D的M层上有7个电子.
(1)填元素符号:A ,B、 ,C ,D .
(2)A、B、C的简单离子半径大小顺序是: .
(3)比较D的气态氢化物与HF的稳定性强弱顺序: .
(1)填元素符号:A
(2)A、B、C的简单离子半径大小顺序是:
(3)比较D的气态氢化物与HF的稳定性强弱顺序:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A元素形成的-2价阴离子比氦的核外电子数多8个,则A的质子数为2+8-2=8,则A为氧元素;B元素的一种氧化物为淡黄色固体,则B为Na元素;C为第三周期的第IIA族金属元素,则C为Mg元素;D的M层上有7个电子,则D为Cl元素,据此解答.
解答:
解:A元素形成的-2价阴离子比氦的核外电子数多8个,则A的质子数为2+8-2=8,则A为氧元素;B元素的一种氧化物为淡黄色固体,则B为Na元素;C为第三周期的第IIA族金属元素,则C为Mg元素;D的M层上有7个电子,则D为Cl元素,
(1)由上述分析可知,A是O、B是Na、C是Mg、D是Cl,
故答案为:O、Na、Mg、Cl;
(2)电子层数相同的离子,核电荷数越多,离子半径越小,所以A、B、C的简单离子半径大小顺序是O2->Na+>Mg 2+,
故答案为:O2->Na+>Mg 2+;
(3)D的气态氢化物为HCl,非金属性F>Cl,故氢化物稳定性HF>HCl,故答案为:HF>HCl.
(1)由上述分析可知,A是O、B是Na、C是Mg、D是Cl,
故答案为:O、Na、Mg、Cl;
(2)电子层数相同的离子,核电荷数越多,离子半径越小,所以A、B、C的简单离子半径大小顺序是O2->Na+>Mg 2+,
故答案为:O2->Na+>Mg 2+;
(3)D的气态氢化物为HCl,非金属性F>Cl,故氢化物稳定性HF>HCl,故答案为:HF>HCl.
点评:本题考查结构性质位置关系的应用,比较基础,推断元素是解题关键,注意元素周期律的理解与应用.

练习册系列答案
相关题目
下列化学反应的离子方程式正确的是( )
| A、铝与硝酸汞溶液:Al+Hg2+═Al3++Hg |
| B、醋酸溶解石灰石:CaCO3+2H+═CO2↑+H2O |
| C、氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
| D、用小苏打(NaHCO3)治疗胃酸(HCl)过多:HCO3-+H+═CO2↑+H2O |
原子序数小于18的元素X,其基态原子L层中有3个未成对电子,则关于这种元素的说法中错误的是( )
| A、该元素是非金属元素 |
| B、该元素最外层有三个电子 |
| C、该元素所形成的最高价氧化物的水化物是一种强酸 |
| D、该元素的第一电离能比同周期右边相邻的元素的第一电离能大 |


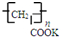 ),聚丙烯酸钾单体的结构简式为
),聚丙烯酸钾单体的结构简式为