题目内容
将常温下pH=12的氢氧化钠溶液与pH=2的硫酸溶液分别加热,溶液pH的变化是( )
| A、前者减少后者不变 |
| B、前者减小后者增大 |
| C、都不变 |
| D、都减小 |
考点:pH的简单计算,电解质在水溶液中的电离
专题:电离平衡与溶液的pH专题
分析:硫酸和NaOH都是强电解质,在水溶液中完全电离,水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大,据此分析解答.
解答:
解:硫酸和NaOH都是强电解质,在水溶液中完全电离,水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大,硫酸中硫酸电离出氢离子浓度远远大于水电离的,所以水的电离几乎不影响溶液中离子浓度,则溶液的pH几乎不变;
NaOH溶液中水电离出氢氧根离子浓度远远小于NaOH电离出的,所以溶液中氢氧根离子浓度几乎不变,水的离子积常数增大,则溶液中氢离子浓度增大,溶液的pH减小,
即溶液的pH前者减小后者不变,故选A.
NaOH溶液中水电离出氢氧根离子浓度远远小于NaOH电离出的,所以溶液中氢氧根离子浓度几乎不变,水的离子积常数增大,则溶液中氢离子浓度增大,溶液的pH减小,
即溶液的pH前者减小后者不变,故选A.
点评:本题考查电解质在水溶液中的电离,知道温度对离子积常数的改变,知道温度只影响强碱溶液pH而不影响强酸溶液pH,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
氯仿(CHCl3,非电解质)在空气中能发生缓慢氧化,生成剧毒物质光气(COCl2,非电解质),化学方程式为:2CHCl3+O2═2COCl2+2HCl.检验氯仿是否被氧化应选择的试剂是( )
| A、淀粉-KI溶液 |
| B、NaOH溶液 |
| C、酚酞溶液 |
| D、硝酸酸化的硝酸银溶液 |
下列叙述中正确的是( )
(1)纯铁比碳素钢易生锈
(2)用氨水除去试管上的银镜
(3)硅是制作光导纤维和制造太阳能电池的主要原料
(4)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性Cl>C(碳)>Si
(5)催化剂只能改变反应的活化能,不能改变反应的热效应
(6)用氢氟酸雕刻玻璃是利用氢氟酸能与二氧化硅反应的性质
(7)同主族元素的简单阴离子还原性越强,水解程度越大
(8)Al2O3在工业上用于制作耐高温材料,也用于电解法治炼铝
(9)丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
(10)明矾可用于水的消毒、杀菌;碳酸钡可用于钡餐透视.
(1)纯铁比碳素钢易生锈
(2)用氨水除去试管上的银镜
(3)硅是制作光导纤维和制造太阳能电池的主要原料
(4)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性Cl>C(碳)>Si
(5)催化剂只能改变反应的活化能,不能改变反应的热效应
(6)用氢氟酸雕刻玻璃是利用氢氟酸能与二氧化硅反应的性质
(7)同主族元素的简单阴离子还原性越强,水解程度越大
(8)Al2O3在工业上用于制作耐高温材料,也用于电解法治炼铝
(9)丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
(10)明矾可用于水的消毒、杀菌;碳酸钡可用于钡餐透视.
| A、(1)(4)(6)(7) |
| B、(4)(6)(9)(10) |
| C、(3)(5)(6)(8) |
| D、(5)(6)(8)(9) |
用NA表示阿伏加德罗常数,下列叙述不正确的是( )
| A、标准状况下,22.4LH2含有的分子数为NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C、通常状况下,NA个 CO2分子占有的体积为22.4L |
| D、1L0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA |
对于反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在其他条件不变的情况下,下列说法正确的是( )
| A、改变压强,平衡不发生移动,反应放出的热量不变 |
| B、若在原电池中进行,反应放出的热量不变 |
| C、升高温度,反应速率加快,反应放出的热量不变 |
| D、加入催化剂,改变了反应的途径,也改变了反应的△H |
家用炒菜铁锅用水清洗放置后出现红棕色的锈斑,在此变化过程中不发生的化学反应是( )
| A、4Fe(OH)2+2H2O+O2=4Fe(OH)3↓ |
| B、2Fe+2H2O+O2=2Fe(OH)2↓ |
| C、2H2O+O2+4e-=4OH- |
| D、Fe-3e-=Fe3+ |
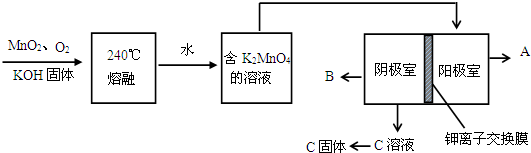
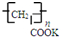 ),聚丙烯酸钾单体的结构简式为
),聚丙烯酸钾单体的结构简式为