题目内容
实验为测定一新配制的稀盐酸的准确浓度,通常用纯净的Na2CO3(无水)配成标准溶液进行滴定.具体操作是:称取w g无水Na2CO3装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定.
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,为准确起见,滴定终点宜选择在pH 4~5之间,则在中学学过的几种指示剂应选 ,当滴定溶液由 色变成 色且 时,即表示达滴定终点.
(2)若所称取的Na2CO3不纯,测得盐酸的浓度就不准确.现设盐酸的准确浓度为c1mol?L-1,用不纯的Na2CO3标定测得盐酸为c2mol?L-1,在下述情况下,c1,c2的关系是:(空填>、<或=)
①当Na2CO3中含有NaCl时,cl c2;
②当Na2CO3中含有NaOH时,cl c2;
③当Na2CO3中含有Na2CO3?10H2O时,cl c2.
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,为准确起见,滴定终点宜选择在pH 4~5之间,则在中学学过的几种指示剂应选
(2)若所称取的Na2CO3不纯,测得盐酸的浓度就不准确.现设盐酸的准确浓度为c1mol?L-1,用不纯的Na2CO3标定测得盐酸为c2mol?L-1,在下述情况下,c1,c2的关系是:(空填>、<或=)
①当Na2CO3中含有NaCl时,cl
②当Na2CO3中含有NaOH时,cl
③当Na2CO3中含有Na2CO3?10H2O时,cl
考点:中和滴定
专题:实验题
分析:(1)石蕊、甲基橙、酚酞三种指示剂中,最能指示反应达到恰好反应的指示剂需要溶液pH为4-5之间,石蕊变色范围宽且颜色不易观察不用,分套指示剂变色范围8-10,产生的误差较大,甲基橙变色范围是3.1-4.4可以指示反应终点;终点颜色变化为溶液由黄色变化为橙色且半分钟不变化;
(2)①NaCl与盐酸不反应;
②等质量的Na2CO3和NaOH与盐酸反应,后者消耗的盐酸多;
③等质量的Na2CO3和Na2CO3?10H2O与盐酸反应,后者消耗的盐酸少.
(2)①NaCl与盐酸不反应;
②等质量的Na2CO3和NaOH与盐酸反应,后者消耗的盐酸多;
③等质量的Na2CO3和Na2CO3?10H2O与盐酸反应,后者消耗的盐酸少.
解答:
解:(1)由于CO2的溶解会影响溶液pH,为准确滴定,终点宜选在溶液pH为4-5之间,石蕊、甲基橙、酚酞三种指示剂中,最能指示反应达到恰好反应的指示剂需要溶液pH为4-5之间,石蕊变色范围宽且颜色不易观察不用,分套指示剂变色范围8-10,产生的误差较大,甲基橙变色范围是3.1-4.4可以指示反应终点;终点颜色变化为溶液由黄色变化为橙色且半分钟不变化,
故答案为:甲基橙;黄色;橙色;半分钟不变色;
(2)①NaCl与盐酸不反应,所以当Na2CO3中含有NaCl时,造成待测测盐酸的体积偏小,即cl>c2;
②等质量的Na2CO3和NaOH与盐酸反应,后者消耗的盐酸多,当Na2CO3中含有NaOH时,造成待测测盐酸的体积偏大,即cl<c2;
③等质量的Na2CO3和Na2CO3?10H2O与盐酸反应,后者消耗的盐酸少,当Na2CO3中含有Na2CO3?10H2O时,造成待测测盐酸的体积偏小,即cl>c2;
故答案为:>;<;>.
故答案为:甲基橙;黄色;橙色;半分钟不变色;
(2)①NaCl与盐酸不反应,所以当Na2CO3中含有NaCl时,造成待测测盐酸的体积偏小,即cl>c2;
②等质量的Na2CO3和NaOH与盐酸反应,后者消耗的盐酸多,当Na2CO3中含有NaOH时,造成待测测盐酸的体积偏大,即cl<c2;
③等质量的Na2CO3和Na2CO3?10H2O与盐酸反应,后者消耗的盐酸少,当Na2CO3中含有Na2CO3?10H2O时,造成待测测盐酸的体积偏小,即cl>c2;
故答案为:>;<;>.
点评:本题考查了酸碱滴定实验的基本操作分析判断,注意掌握误差分析的原理是解题的关键,题目较简单.

练习册系列答案
相关题目
①1mol某链烃最多能和2mol HCl发生加成反应,生成1mol氯代烷;②1mol该氯代烷能和8mol Cl2发生取代反应,生成只含碳元素和氯元素的氯代烃.该链烃可能是( )
| A、CH3CH═CH2 |
| B、CH2═CHCH═CH2 |
| C、CH3CH═CHCH3 |
| D、CH3C≡CH |
 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )| A、c点表示CH3COOH和NaOH恰好反应完全 | ||
| B、b点表示的溶液中c(CH3COO-)>c(Na+) | ||
| C、a点表示溶液中c(CH3COO-)约为10-3mol/L | ||
D、b、d点表示的溶液中
|
用NA表示阿伏加德罗常数,下列叙述不正确的是( )
| A、标准状况下,22.4LH2含有的分子数为NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C、通常状况下,NA个 CO2分子占有的体积为22.4L |
| D、1L0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA |
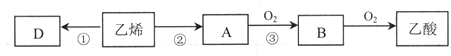
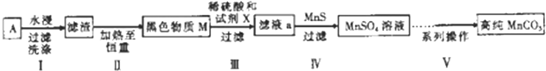
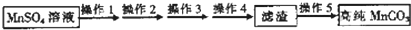
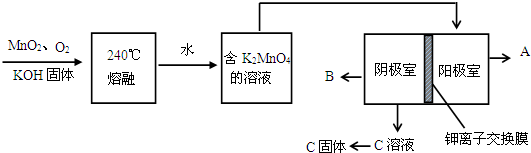
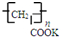 ),聚丙烯酸钾单体的结构简式为
),聚丙烯酸钾单体的结构简式为