题目内容
8.配置一定物质的量浓度的NaOH溶液时,造成实验结果偏高的是( )| A. | 定容时俯视液面 | B. | 容量瓶洗净后有少量水残留 | ||
| C. | 转移时没有洗涤烧杯和玻璃 | D. | 所用的氢氧化钠已吸水潮解 |
分析 根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:A.定容时俯视液面,则溶液体积偏小,浓度偏高,故A正确;
B.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故B错误;
C.转移时没有洗涤烧杯和玻璃,会导致溶质的损失,则浓度偏低,故C错误;
D.氢氧化钠固体潮解,即氢氧化钠中含有水,所以这样会引起溶质质量减少,即造成浓度偏低,故D错误;
故选A.
点评 本题考查了一定物质的量浓度溶液的配制过程中的误差分析,属于基础型题目,根据c=$\frac{n}{V}$分析是解答关键,题目难度不大.

练习册系列答案
相关题目
16.下列叙述正确的是( )
| A. | 配制100mL 1.0mol/LCuSO4溶液:将25g CuSO4•5H2O溶于100mL蒸馏水中 | |
| B. | 配制6mol/L100mL硫酸时,定容后应将容量瓶沿顺时针方向摇匀 | |
| C. | 盛放NaOH溶液时,使用带玻璃塞的磨口瓶 | |
| D. | 可以采用溶解、蒸发浓缩、冷却结晶、过滤的方法分离NaCl和KNO3固体混合物 |
3.为了增强漂白粉的漂白能力,常在漂白粉溶液中加入少量的( )
| A. | NaOH | B. | NaCl | C. | HCl | D. | Ca(ClO)2 |
13.对于氨水的电离,下列哪个量只随温度变化而变化( )
| A. | 溶液的pH值 | B. | 电离度 | ||
| C. | 电离平衡常数 | D. | 平衡后,氨水的电离速率 |
20.实验室需配制450ml 0.1mol/L的Na2CO3溶液,以下操作正确的是( )
| A. | 称取4.77g Na2CO3固体溶于水配成450mL溶液 | |
| B. | 称取5.3g Na2CO3固体溶于水配成500mL溶液 | |
| C. | 称取12.9g Na2CO3•10H2O 固体溶于水配成450mL溶液 | |
| D. | 量取90mL 0.5mol/L Na2CO3溶液加360mL水稀释 |
17.关于溶解平衡的说法中,错误的是( )
| A. | 溶解平衡的本质是结晶速率等于溶解速率 | |
| B. | 在不饱和溶液中,溶质的溶解速率小于结晶速率 | |
| C. | 在饱和溶液中,晶体的质量不改变,形状可能改变 | |
| D. | 当物质达到溶解平衡时,不改变外界条件,溶液的浓度也不改变 |
 pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是
pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是

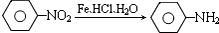 (苯胺、弱碱性、易被氧化)
(苯胺、弱碱性、易被氧化)
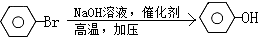


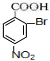 D:
D: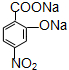 ;
;