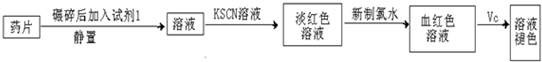
��Ŀ����
18���ݱ�����Ŀǰ�ҹ���˲��ķ�������̧ͷ�����ƣ����ƽ�˸˾���ҩ��������⣬PAS-Na������ˮ�����ƣ�Ҳ������һ�֣���֪����
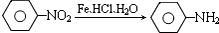 �������������ԡ��ױ�������
�������������ԡ��ױ���������

��
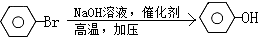
������PAS-Na��һ�ֺϳ�·�ߣ����ַ�Ӧ������δע������

��Ҫ��ش����⣺
��1��A��Ũ�����Ũ����Ļ������Է���ȡ����Ӧ����30��ʱ��Ӧ��Ҫ�õ�B������һ��ͬ���칹�壬��һ��������Ҳ���Է�Ӧ����TNT����д����A��ȡTNT�Ļ�ѧ��Ӧ����ʽ

��2��д�������ʵĽṹ��ʽC��
 D��
D��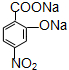 ��
����3��д�������Լ��Ļ�ѧʽX�����Ը��������ҺY��NaHCO3��Һ��
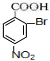
��4�������ϳ�·���У�����ʽΪC7H6BrNO2�Ĺ���������Ϊ��������ԭ�ӣ�����������ͬ�����Ų����ڷ����廯�����ͬ���칹����17�֣�����������
���� �ɶ���ˮ�����ƵĽṹ��֪AӦΪ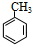 ����Ũ���ᣬ��Ũ���ᡢ���������·���������Ӧ����B���ɶ���ˮ�������а�����-COONa��λ�ÿ�֪��A��������λȡ������B����BΪ
����Ũ���ᣬ��Ũ���ᡢ���������·���������Ӧ����B���ɶ���ˮ�������а�����-COONa��λ�ÿ�֪��A��������λȡ������B����BΪ ��B������Fe�����������·���ȡ����Ӧ���ɶ���ˮ�����ƵĽṹ��֪��Ӧ����������λȡ������C7H6BrNO2�Ľṹ��ʽΪ
��B������Fe�����������·���ȡ����Ӧ���ɶ���ˮ�����ƵĽṹ��֪��Ӧ����������λȡ������C7H6BrNO2�Ľṹ��ʽΪ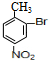 �����ڷ��ǻ��������ױ�������������C�ķ�ӦΪ������Ӧ��
�����ڷ��ǻ��������ױ�������������C�ķ�ӦΪ������Ӧ�� �����Ը��������������C����CΪ
�����Ը��������������C����CΪ ��C�ڼ���������ˮ������DΪ
��C�ڼ���������ˮ������DΪ ��D��Fe��HCl��ˮ�����·�����ԭ����E����EΪ
��D��Fe��HCl��ˮ�����·�����ԭ����E����EΪ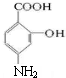 ��E��̼�����Ʒ�Ӧ���ɰ���ˮ�����ƣ�
��E��̼�����Ʒ�Ӧ���ɰ���ˮ�����ƣ�
��� �⣺�ɶ���ˮ�����ƵĽṹ��֪AӦΪ ����Ũ���ᣬ��Ũ���ᡢ���������·���������Ӧ����B���ɶ���ˮ�������а�����-COONa��λ�ÿ�֪��A��������λȡ������B����BΪ
����Ũ���ᣬ��Ũ���ᡢ���������·���������Ӧ����B���ɶ���ˮ�������а�����-COONa��λ�ÿ�֪��A��������λȡ������B����BΪ ��B������Fe�����������·���ȡ����Ӧ���ɶ���ˮ�����ƵĽṹ��֪��Ӧ����������λȡ������C7H6BrNO2�Ľṹ��ʽΪ
��B������Fe�����������·���ȡ����Ӧ���ɶ���ˮ�����ƵĽṹ��֪��Ӧ����������λȡ������C7H6BrNO2�Ľṹ��ʽΪ �����ڷ��ǻ��������ױ�������������C�ķ�ӦΪ������Ӧ��
�����ڷ��ǻ��������ױ�������������C�ķ�ӦΪ������Ӧ�� �����Ը��������������C����CΪ
�����Ը��������������C����CΪ ��C�ڼ���������ˮ������DΪ
��C�ڼ���������ˮ������DΪ ��D��Fe��HCl��ˮ�����·�����ԭ����E����EΪ
��D��Fe��HCl��ˮ�����·�����ԭ����E����EΪ ��E��̼�����Ʒ�Ӧ���ɰ���ˮ�����ƣ�
��E��̼�����Ʒ�Ӧ���ɰ���ˮ�����ƣ�
��1��A��ȡTNT�Ļ�ѧ��Ӧ����ʽ�� ��
��
�ʴ�Ϊ�� ��
��
��2��������������֪��C�Ľṹ��ʽΪ ��D�Ľṹ��ʽΪ
��D�Ľṹ��ʽΪ ��
��
�ʴ�Ϊ�� ��
�� ��
��
��3������������֪���Լ�XΪ���Ը��������Һ���Լ�YΪNaHCO3��Һ��
�ʴ�Ϊ�����Ը��������Һ��NaHCO3��Һ��
��4��C7H6BrNO2�Ľṹ��ʽΪ �����еĹ���������ԭ�ӡ���������
�����еĹ���������ԭ�ӡ��������� ������ͬ�����ŵ�ͬ���칹�岢���ڷ����廯�������Ϊ������������������-CH3��-NO2��-Br����-CH3��-NO2������λʱ��-Br��4��λ�ã���-CH3��-NO2���ڼ�λʱ��-Br��4��λ�ã���-CH3��-NO2���ڶ�λʱ��-Br��2��λ�ã������Ľṹ��10�֣��������������к�������ȡ������-CH2Br��-NO2��-CH2NO2��-Br���������ڡ��䡢��λ�ã������Ľṹ����6�֣�����һ������-CH��Br��NO2�����Թ���17�֣�
������ͬ�����ŵ�ͬ���칹�岢���ڷ����廯�������Ϊ������������������-CH3��-NO2��-Br����-CH3��-NO2������λʱ��-Br��4��λ�ã���-CH3��-NO2���ڼ�λʱ��-Br��4��λ�ã���-CH3��-NO2���ڶ�λʱ��-Br��2��λ�ã������Ľṹ��10�֣��������������к�������ȡ������-CH2Br��-NO2��-CH2NO2��-Br���������ڡ��䡢��λ�ã������Ľṹ����6�֣�����һ������-CH��Br��NO2�����Թ���17�֣�
�ʴ�Ϊ����������ԭ�ӣ�17��
���� ���⿼���л�����ƶϣ���Ŀ�Ѷ��еȣ�ע���-COOH��-CH3������������-NH2��-NO2��ԭ���ã��ʵ�һ����Ӧ-NO2���뵽-CH3�Ķ�λ�ϣ���-OH��-Xˮ��ã��ʵڶ�����Ӧ-Br���뵽-CH3����λ�ϣ�����ʱע����ᣮ

| A�� | ����ʱ����Һ�� | B�� | ����ƿϴ����������ˮ���� | ||
| C�� | ת��ʱû��ϴ���ձ��Ͳ��� | D�� | ���õ�������������ˮ���� |
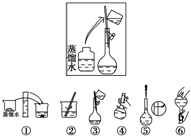 ijͬѧ����ˮ�ʼ��վ����500mL 0.5mol•L-1NaOH��Һ�Ա�ʹ�ã������������ͼ��ʾ�����в�����λ��Ϊ��������
ijͬѧ����ˮ�ʼ��վ����500mL 0.5mol•L-1NaOH��Һ�Ա�ʹ�ã������������ͼ��ʾ�����в�����λ��Ϊ��������| A�� | �����֮�� | B�� | �����֮�� | C�� | �����֮�� | D�� | �����֮�� |
��pH��ֽ���飬��Һ��pH��7��
��ȡ����ԭ��Һ������Һ�м��������BaCl2������Ļ����Һ���ް�ɫ�������ɣ�
����ȡ����ԭ��Һ������Һ�еμ�������ˮ��������������ټ���CCl4�����ú�CCl4��ʳ�ɫ���÷�Һ©����Һ��
�����Һ���ˮ��Һ�м���Ba��NO3��2��Һ��HNO3��Һ���а�ɫ�������������ˣ�
������Һ�м���AgNO3��HNO3�Ļ����Һ�а�ɫ����������
�����ԭ��Һ���ж��в���ȷ���ǣ�������
| A�� | �϶������ڵ�������Fe3+��Cu2+��NH4+��SO42-��CO32- | |
| B�� | �϶����ڵ�������Na+��K+��SO32-��Br- | |
| C�� | ��ȷ��ԭ��Һ���Ƿ����Cl- | |
| D�� | ������ܸ���BaCl2��Һ������Ļ����Һ�������Һ�����ӵ��ж���Ӱ�� |
| A�� | һ�� | B�� | ���� | C�� | ���� | D�� | ���� |
| A�� | ��״���£�22.4 L�����й��ۼ���ĿΪ19NA | |
| B�� | �����£�0.1 mol��������ϩ�������������̼ԭ����Ϊ0.2NA | |
| C�� | �ڱ�״���£�2.24 L���ȼ���������������Ϊ0.1NA | |
| D�� | 1 mol�������к���̼̼˫����Ϊ3 NA |
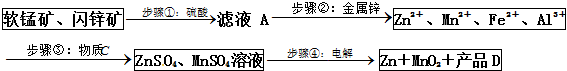
��֪���ֽ���������ȫ������pH���±���
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
��1��������У����̿���п�����������Һ����ʱ������ķ�ӦΪ������ԭ��Ӧ�����磺MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S��+2H2O����д��MnO2��������Һ�зֱ��CuS��FeS������Ӧ�Ļ�ѧ����ʽ��MnO2+CuS+2H2SO4=MnSO4+CuSO4+S��+2H2O��MnO2+2FeS+6H2SO4=Fe2��SO4��3+3MnSO4+2S��+6H2O��
��2������ڼ������п��Ϊ�˻��ս��������ս�������Ҫ�ɷ�ΪCu��Cd���û�ѧ���ű�ʾ��
��3�����������C�ɶ���������ɣ����к������ֹ��壬����һ��ΪMnO2���������ǽ�Fe2+����ΪFe3+������һ�ֹ������ʿ�ΪZn��OH��2��
��4��������е�������MnO2�������������õ缫�Ϸ����ķ�Ӧ����ʽΪMn2+-2e-+2H2O=MnO2+4H+����ƷD�Ļ�ѧʽΪH2SO4�������ʶ����������������������ܽ����̿����п��ѭ��ʹ�ã�
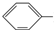 X+CH2=CH-M$��_{��}^{Pb}$
X+CH2=CH-M$��_{��}^{Pb}$ CH�TCH-M+HX��XΪ±ԭ�ӣ�MΪ������������ȡ�����ȣ�
CH�TCH-M+HX��XΪ±ԭ�ӣ�MΪ������������ȡ�����ȣ�
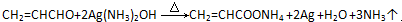 ��
�� ��
��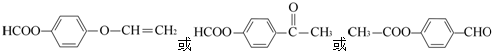 ��
�� ���������㶹�ص����Ʒ����������㶹�غ�����һ��ͬ���칹�壨
���������㶹�ص����Ʒ����������㶹�غ�����һ��ͬ���칹�壨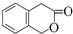 ����Ҫ�õ����Լ��У�NaOH��Һ��ϡ���ᡢ�Ȼ�����Һ��
����Ҫ�õ����Լ��У�NaOH��Һ��ϡ���ᡢ�Ȼ�����Һ��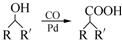 ��R��R��Ϊ����������д���Ա��ͱ�ϩ��CH2=CH-CH3��Ϊԭ�ϣ��ϳ�
��R��R��Ϊ����������д���Ա��ͱ�ϩ��CH2=CH-CH3��Ϊԭ�ϣ��ϳ� ��·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�H2C=CH2$\stackrel{HBr}{��}$CH3CH2Br$��_{��}^{Na_{3}CH_{2}Br��Һ}$CH3CH2OH��
��·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�H2C=CH2$\stackrel{HBr}{��}$CH3CH2Br$��_{��}^{Na_{3}CH_{2}Br��Һ}$CH3CH2OH��